题目内容
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
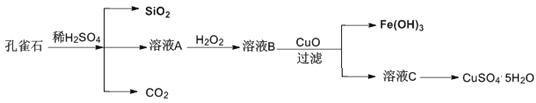
请回答下列问题:
(1)溶液A的金属离子有Fe3+和______________。
(2)溶液A中加入H2O2的目的是______________,发生的离子方程式为_____________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、______________、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为________________________。
【答案】Cu2+、Fe2+ 将Fe2+氧化为Fe3+ 2Fe2++2H++H2O2=2Fe3++2H2O 冷却结晶 Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4
【解析】
孔雀石的主要成分是CuCO3·Cu(OH)2,少量杂质FeO、Fe2O3、SiO2,加入过量稀硫酸,生成二氧化碳气体,溶液A含有硫酸铜、硫酸亚铁、硫酸铁,加入过氧化氢将硫酸亚铁氧化成硫酸铁,加入CuO可调节溶液pH,利于铁离子的水解而生成氢氧化铁沉淀,过滤分离出的溶液C为硫酸铜溶液,经加热蒸发、冷却结晶、过滤等操作可得到硫酸铜晶体,以此来解答。
(1)由上述分析可知,溶液A的金属离子有Fe3+和Cu2+、Fe2+,故答案为:Cu2+、Fe2+;
(2)溶液A中加入H2O2的目的是将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、冷却结晶、过滤等操作,故答案为:冷却结晶;
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4,故答案为:Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4。

 新思维寒假作业系列答案
新思维寒假作业系列答案