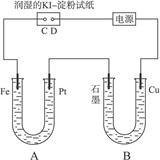
题目内容
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
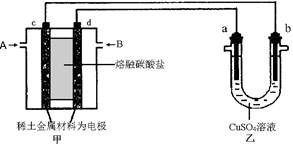
① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
(1) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -890.31kJ·mol-1 (2分)
(2) +131.5 kJ·mol-1 (2分)
(3) ① 增大 (1分)
② 否 (1分) 因为Qc=c(CO2)/c(CO)=0.25<K=0.263 (2分)
(4) ① CO2 (2分) O2+4e-+2CO2=2CO32- (2分)
② 4OH--4e- = O2↑+2H2O (2分) 56 (2分) 1 (2分)
③ (w×142/322)/( w+18a)×100% (2分)
(2) +131.5 kJ·mol-1 (2分)
(3) ① 增大 (1分)
② 否 (1分) 因为Qc=c(CO2)/c(CO)=0.25<K=0.263 (2分)
(4) ① CO2 (2分) O2+4e-+2CO2=2CO32- (2分)
② 4OH--4e- = O2↑+2H2O (2分) 56 (2分) 1 (2分)
③ (w×142/322)/( w+18a)×100% (2分)
本题为化学反应与能量综合考查题。(1)为热化学方程式的书写,需要注意问题有反应与计量系数的对应关系,物质状态,吸热与放热等,可以写出CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -890.31kJ·mol-1 ;(2)考查盖斯定律的应用。三个方程式依次编号为①②③,目标方程式等于①-②-③,故ΔH=-437.3-(-285.8)-(-283.0)=+131.5KJ/mol;(3)平衡常数只与温度有关,温度升高,平衡正向移动,故K增大,Q==0.25<K,故平衡平衡正向移动;(4)甲为燃料电池,乙为电解池,b有红色物质析出,发生Cu2++2e-=Cu,为阴极,故A为负极,通入CH4,d为正极电解质为熔融的碳酸盐,故有 O2+4e-+2CO2= CO;将CuSO4换成Na2SO4;阳极产生O2,阴极产生H2,amol,故电解水为amol,18ag,原来为饱和溶液,电解后还是饱和溶液。将wgNa2SO4·10H2O溶解在18ag水中同样为饱和溶液,故溶质的质量分数为×100%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: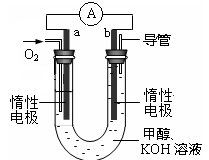
 不正确的是
不正确的是


 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
 C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是