题目内容
在一密闭容器中,发生反应:A(g)+B(g)  C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
A.若A的浓度增加到原平衡的2倍,则平衡一定正向移动
B.该反应的ΔH>0
C.在850℃条件下,反应达到平衡时,容器中各物质的浓度一定相等
D.A的转化率越大,平衡常数越大
 C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是| T/℃ | 800 | 850 | 1 000 | 1 200 |
| K | 0.9 | 1.0 | 1.7 | 2.4 |
B.该反应的ΔH>0
C.在850℃条件下,反应达到平衡时,容器中各物质的浓度一定相等
D.A的转化率越大,平衡常数越大
B
所给反应为两边气体系数相等的可逆反应,升温时K增大,即平衡右移,正反应为吸热反应,也就是说ΔH>0,B正确
A:比如将容器体积减小为原来的一半,各物质的浓度均为原来的两倍,相当于加压,平衡并不移动;
C:在850℃条件下,反应达到平衡时,K=1=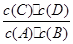 ,而不是各物质的浓度相等。
,而不是各物质的浓度相等。
D:平衡常数只与温度相关,而与A的转化率无必然联系
A:比如将容器体积减小为原来的一半,各物质的浓度均为原来的两倍,相当于加压,平衡并不移动;
C:在850℃条件下,反应达到平衡时,K=1=
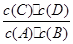 ,而不是各物质的浓度相等。
,而不是各物质的浓度相等。D:平衡常数只与温度相关,而与A的转化率无必然联系

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
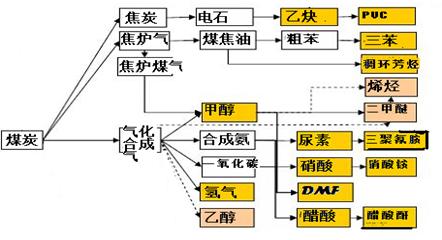
 7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下: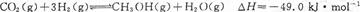
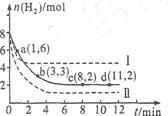
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
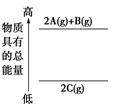
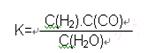
 2CO(g),K1
2CO(g),K1 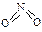 和
和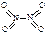 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。 、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。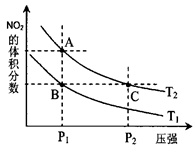
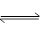 2SO3”为可逆反应,请回答:
2SO3”为可逆反应,请回答: