题目内容
下列说法不正确的是
| A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积不变 |
| B.NH3(g)+HCl(g)==NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
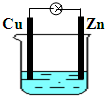
| C.铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
C
A.水的离子积只与温度有关
B.NH3(g)+HCl(g)==NH4Cl(s) △H<0,△S<0,由△G=△H—T△S,可知:低于一定温度自发,高于一定温度非自发
C.铅蓄电池在放电过程中,负极铅和正极二氧化铅均转变为硫酸铅,质量均增加
D.虽然BaSO4电离出的Ba2+浓度较小,但饱和Na2CO3溶液可提供高浓度的CO32-,当溶液中BaCO3的Q c大于其Ksp时,即可生成BaCO3
故答案为C

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0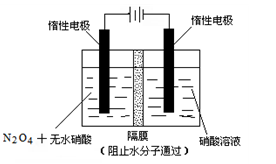
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。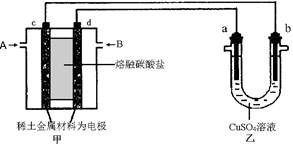
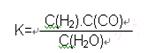
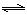 2CO(g),K1
2CO(g),K1 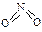 和
和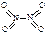 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。 、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。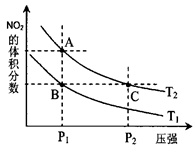
 N2+2CO2。
N2+2CO2。 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol 出行
出行