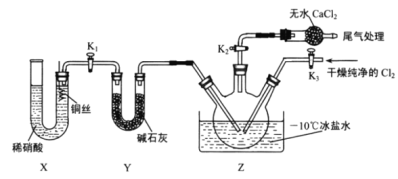
题目内容
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
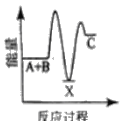
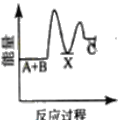
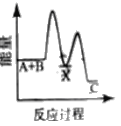
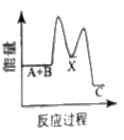
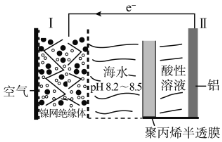
①用次氯酸钠除去氨氮的原理如图所示:
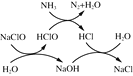
写出该图示的总反应化学方程式:__________________。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________。
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:
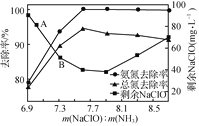
当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___。
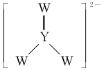
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:
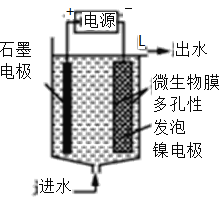
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
【答案】8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=(2c-7a-3b)kJ·mol-1 2NH3+3NaClO=N2+3NaCl+3H2O 温度过高,HClO发生分解,氨氮去除率随之降低 有部分NH3被氧化成NO2—或NO3— 2NO3—+10H+=N2↑+2OH—+4H2O 0.08
【解析】
(1)已知:已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
根据盖斯定律得③×27×①3×②得到反应8NH3(g)+6NO2(g)═7N2(g)+12H2O(l) △H=(2c7a3b) kJ·mol![]() ,
,
故答案为:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=(2c-7a-3b)kJ·mol-1;
(2)①根据图示,由始态和终态判断反应物中NH3被氧化为N2,则NaClO被还原为NaCl,生成1molN2转移6mol电子,根据转移电子守恒需要3molNaClO,再结合元素守恒,写出化学方程式2NH3+3NaClO=N2↑+3NaCl+3H2O;温度对化学反应速率有影响,温度越高,化学反应率越快。所以温度低时,去除率低的原因是反应速率慢,HClO不稳定,易分解,温度高时,加快了HClO的分解速率,从而使去除率降低,
故答案为:2NH3+3NaClO=N2↑+3NaCl+3H2O ;温度过高,HClO发生分解,氨氮去除率随之降低;
②当m(NaClO)∶m(NH3)>7.6时,总氮的去除率随m(NaClO):m(NH3)的增大不升反降的原因是:NaClO投入过多会将部分NH3氧化为NO2—或NO3—等更高价态的物质,未能从溶液中除去,
故答案为:有部分NH3被氧化成NO2—或NO3—;
(3)①活性原子与NO3—反应是电解过程中生成的氢离子还原硝酸根离子生成氮气,反应的离子方程式:2NO3—+10H+=N2↑+2OH—+4H2O,
故答案为:2NO3—+10H+=N2↑+2OH—+4H2O;
②若阳极生成标准状况下2.24L气体,则此气体为氢氧根离子失电子生成的氧气,其物质的量=![]() ,由2NO3—+10H+=N2↑+2OH—+4H2O 可知,2NO3—N2↑10e2.5O2,电子守恒计算得到理论上可除去NO3—的物质的量为0.08mol,
,由2NO3—+10H+=N2↑+2OH—+4H2O 可知,2NO3—N2↑10e2.5O2,电子守恒计算得到理论上可除去NO3—的物质的量为0.08mol,
故答案为:0.08。

 名校课堂系列答案
名校课堂系列答案【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:

已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。