题目内容
(15分)A、B、C、D、E、F六种元素分布在三个不同的短周期,他们的原子序数依次增大,其中 B与C为同一周期,A 与D,C与F分别在同一主族 ,A、D两元素原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,请回答下列问题:
(1)由A、B两种元素可以组成B2A4型化合物,该化合物中存在的共价键类型为是 。写出该化合物的电子式
(2)E 是非金属元素,但能表现出一些金属元素的性质,写出E与D元素的最高价氧化物的水化物反应的离子方程式 。
(3)等浓度的ABC2溶液、HClO溶液、盐酸溶液,其导电能力:盐酸溶液>ABC2溶液>HClO溶液,则溶液的 pH (DBC2 ) pH(DClO)(填“>、<、=”)理由是 (用离子方程式解释)
(4)现有100.00mL 未知浓度的ABC2溶液,用 (仪器名称)量取10.00mL待测溶液于锥形瓶中,加入几滴 (可选指示剂:酚酞、石蕊、甲基橙),用A、C、 D三种元素组成的浓度为0.10mol/L的标准溶液来测定未知浓度的ABC2溶液,判断滴定终点的现象是 ;记录消耗标准溶液的体积为12.00mL,则该ABC2溶液的浓度为mol/L;
(1) 极性和非极性 (2分) 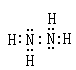 (2分)
(2分)
(2) Si + 2OH- + H2O = SiO32- + 2H2 (2分)
(3) < (1分) NO2- + H2O 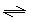 HNO2 +OH- , ClO- + H2O
HNO2 +OH- , ClO- + H2O 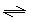 HClO + OH-后者水解程度大于前者(3分)
HClO + OH-后者水解程度大于前者(3分)
(4) 酸式滴定管(1分) , 酚酞(1分) , 溶液由无色变粉红色半分钟不褪色(1分),
0.12 (2分)
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.