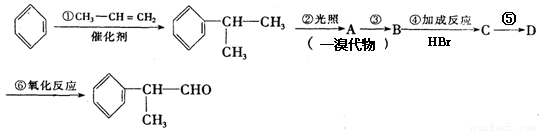
题目内容
3.图装置,电流计指针会偏转,正极变粗,负极变细,符合这种情况的是( )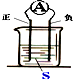
| A. | 正极:Cu 负极:Zn S:稀H2SO4 | |
| B. | 正极:Zn 负极:Cu S:CuSO4溶液 | |
| C. | 正极:Ag 负极:Zn S:AgNO3溶液 | |
| D. | 正极:Fe 负极:Cu S:AgNO3溶液 |
分析 负极变细说明负极是金属,正极变粗说明有金属析出,电流计指针会偏转说明有电流通过,即该装置构成了原电池装置.
解答 解:A、硫酸为电解质溶液,正极生成氢气,不能变粗,故A错误;
B、原电池中CuSO4溶液做电解质时,活泼金属做负极,则应为Zn作负极,故B错误;
C、锌为负极,硝酸银为电解质,则锌失去生成离子进入溶液,正极上银离子得到电子,生成单质析出,故C正确;
D、原电池中硝酸银溶液做电解质时,活泼金属做负极,则应为Fe作负极,故D错误.
故选C.
点评 本题考查原电池装置及工作原理,熟悉金属的活泼性及发生的氧化还原反应是解答本题的关键,较为基础.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
13.能够一次性操作就能鉴别Na2SO3、BaCl2、NaCl、Na2CO3四种物质的一种试剂是( )
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | 稀HNO3 |
14.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后铁完全反应,同时析出0.1mol Ag.则下列结论中不正确的是( )
| A. | 向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解 | |
| B. | 氧化性:Ag+>Fe3+>Cu2+>Zn2+ | |
| C. | 反应后溶液的质量减轻 | |
| D. | 反应后溶液中Cu2+与Fe2+的物质的量之比为1:1 |
14.下列反应的离子方程式中正确的是( )
| A. | Na2O2与水反应:Na2O2+2H20═2Na++2OH-+H2↑ | |
| B. | FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O | |
| C. | 向Na2SiO3溶液中通人过量的SO2:SiO32-+SO2+H2O═Na2SiO3↓+SO32- | |
| D. | NH4HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20 |
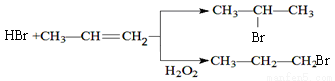
11.某羧酸酯的分子式为C10H18O3,1mol该酯完全水解可得到1mol羧酸和1mol乙醇,该羧酸的分子式为( )
| A. | C8H16O2 | B. | C8H16O3 | C. | C8H14O2 | D. | C8H14O3 |
 的物质,该物质是一种香料。
的物质,该物质是一种香料。