题目内容
14.下列反应的离子方程式中正确的是( )| A. | Na2O2与水反应:Na2O2+2H20═2Na++2OH-+H2↑ | |
| B. | FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O | |
| C. | 向Na2SiO3溶液中通人过量的SO2:SiO32-+SO2+H2O═Na2SiO3↓+SO32- | |
| D. | NH4HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20 |
分析 A.过氧化钠与水反应生成的是氧气,不是氢气;
B.该反应两边正电荷不相等,违反了电荷守恒;
C.二氧化硫过量,反应生成亚硫酸氢根离子;
D.氢氧化钙过量,离子方程式按照碳酸氢铵的化学式书写.
解答 解:A.Na2O2与水反应生成氢氧化钠和氧气,正确的离子方程式为:Na2O2+2H20═2Na++2OH-+O2↑,故A错误;
B.FeSO4溶液与H2O2溶液混合,二者发生氧化还原反应,正确的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故B错误;
C.向Na2SiO3溶液中通人过量的SO2,反应生成硅酸沉淀和亚硫酸氢钠,正确的离子方程式为:SiO32-+2SO2+2H2O═H2SiO3↓+2HSO3-,故C错误;
D.NH4HCO3稀溶液与过量的Ca(OH)2溶液混合,反应的离子方程式为:NH4++HC03-+Ca2++2OH-═CaCO3↓+NH3•H2O+H20,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考中高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | “天宫一号”中使用的碳纤维,是一种符合材料 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硅胶 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| D. | 光导纤维是传统无机非金属材料 |
3.图装置,电流计指针会偏转,正极变粗,负极变细,符合这种情况的是( )
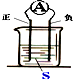

| A. | 正极:Cu 负极:Zn S:稀H2SO4 | |
| B. | 正极:Zn 负极:Cu S:CuSO4溶液 | |
| C. | 正极:Ag 负极:Zn S:AgNO3溶液 | |
| D. | 正极:Fe 负极:Cu S:AgNO3溶液 |
9.下列说法错误的是( )
| A. | 硝酸能溶解除金、铂外的大多数金属 | |
| B. | 汽车尾气中含有NO和CO | |
| C. | 浓氨水可检验氯气管道漏气 | |
| D. | 制取二氧化氮时,常用水吸收尾气 |
2. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | H2O2分解的热化学方程式:H2O2═H2O+$\frac{1}{2}$O2△H<0 |
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.
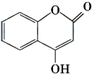 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: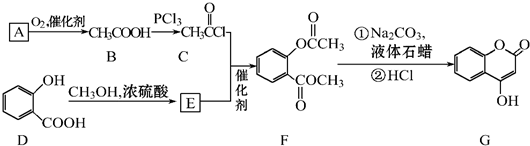
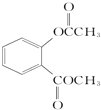 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.