题目内容
10.以铝合金、Pt-Fe合金网为电极材料制成海水电池.下列关于这种电池的说法:①铝合金是阳极、②铝合金是负极、③海水是电解液、④铝合金电极发生还原反应,其中正确的是( )| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
分析 铝合金、Pt-Fe合金网为电极材料的海水电池中,由于铝较铁活泼,所以铝作负极,Pt-Fe合金作正极,海水是电解液.
解答 解:电池电极只称为正、负极,故①错;
其中活泼的一极为负极,即为铝合金,故②对;
电极在海水中,海水中含有大量的电解质,故③对;
铝合金为负极,则发生氧化反应,故④错;
故选A.
点评 本题考查原电池的构成及电极反应的判断,题目难度较小,明确金属的活泼性及原电池原理即可解答.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
3.图装置,电流计指针会偏转,正极变粗,负极变细,符合这种情况的是( )
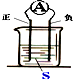

| A. | 正极:Cu 负极:Zn S:稀H2SO4 | |
| B. | 正极:Zn 负极:Cu S:CuSO4溶液 | |
| C. | 正极:Ag 负极:Zn S:AgNO3溶液 | |
| D. | 正极:Fe 负极:Cu S:AgNO3溶液 |
18.卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子,以卤块为原料制取轻质氧化镁工艺以及相关数据如图:
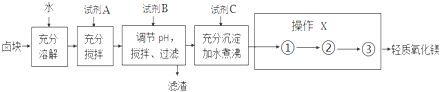
若要求产品尽量不含杂质,而且生产成本较低,请根据如表提供的资料,回答下列问题:
表1 生成氢氧化沉淀的pH
Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为 Fe3+,生成 Fe(OH)3沉淀除去
表2 原料价格表
(1)要使卤块充分溶解,可采取的措施有适当加热、搅拌、将卤块粉碎等(至少答2点)
(2)加入的试剂A,最佳的选择是漂液.
(3)为尽量除去杂质,试剂B为NaOH,当溶液的pH为9.8时,停止加入B.
(4)操作X中①②③步的操作分别是过滤、洗涤、灼烧、检验步骤②是否进行完全的操作是:取最后一次洗涤液少许做焰色反应.
(5)加入的试剂C是 Na2CO3,煮沸发生的反应方程式为MgCO3+H2O$\frac{\underline{\;加热煮沸\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,请根据如表提供的资料,回答下列问题:
表1 生成氢氧化沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格/(元•吨-1) |
| 漂液(含 25.2% NaClO) | 450 |
| 双氧水(含 30% H2O2) | 2400 |
| 烧碱(含 98% NaOH) | 2100 |
| 纯碱(含 99.5% Na2CO3) | 600 |
(2)加入的试剂A,最佳的选择是漂液.
(3)为尽量除去杂质,试剂B为NaOH,当溶液的pH为9.8时,停止加入B.
(4)操作X中①②③步的操作分别是过滤、洗涤、灼烧、检验步骤②是否进行完全的操作是:取最后一次洗涤液少许做焰色反应.
(5)加入的试剂C是 Na2CO3,煮沸发生的反应方程式为MgCO3+H2O$\frac{\underline{\;加热煮沸\;}}{\;}$Mg(OH)2+CO2↑.
15.属于同系物的一组物质是( )
| A. | 35Cl2、37Cl2、35Cl、37Cl | B. | -OH、-CH2OH、-CH2CH2OH | ||
| C. | CH4、CH3CH(CH3)2、(CH3)3CCH2CH3 | D. | 一氯甲烷、二氯甲烷、三氯甲烷 |
2. 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | H2O2分解的热化学方程式:H2O2═H2O+$\frac{1}{2}$O2△H<0 |
19.在某温度下,反应ClF(g)+F2(g)?ClF3(g)(正反应为放热反应)在密闭容器中达到平衡.下列说法正确的是( )
| A. | 温度不变,缩小体积,ClF的转化率减小 | |
| B. | 温度不变,增大体积,ClF3的产率提高 | |
| C. | 升高温度,增大体积,平衡向正反应方向移动 | |
| D. | 降低温度,体积不变,F2的转化率升高 |
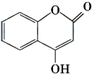 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: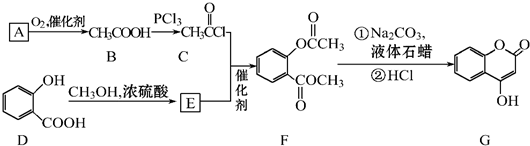
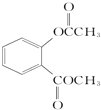 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.