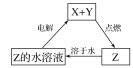
题目内容
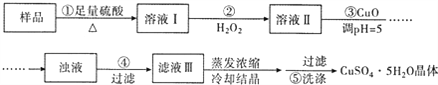
【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
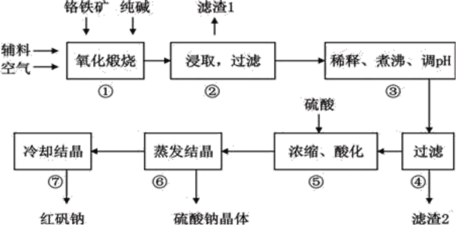
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
【答案】使反应物接触更充分,加快反应速率 除去溶液中的AlO2-、SiO32- 2CrO42-+2H+![]() Cr2O72-+H2O 红矾钠的溶解度随温度的降低而减小 2.4×10-4 CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 12.51
Cr2O72-+H2O 红矾钠的溶解度随温度的降低而减小 2.4×10-4 CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O 12.51
【解析】
以铬铁矿为原料制备重铬酸钠,铬铁矿经煅烧、水浸之后除去生成的氧化铁,调节pH至4.7,使溶液中的AlO2-、SiO32-转化为Al(OH)3、H2SiO3沉淀除去;然后将滤液经酸化、蒸发结晶后可生成重铬酸钠。
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是作用是使反应物接触更充分,达到加快反应速率的目的;
(2)③中调节pH至4.7,目的是使溶液中的AlO2-、SiO32-转化为Al(OH)3、H2SiO3沉淀除去;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,该反应的离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(4)⑦中采用冷却结晶的方法析出红矾钠,是由于红矾钠的溶解度随温度的降低而减小,降低温度,可以降低红矾钠的溶解度,从而结晶析出;
(5)①由于Ksp(BaCrO4)=1.2×10-10,Ksp(BaCrO4)=c(Ba2+)·c(CrO42-),含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放,所以此时溶液中c(Ba2+)=![]() mol/L=2.4×10-4 mol/L;
mol/L=2.4×10-4 mol/L;
②CrO42-、Fe2+在酸性条件下发生氧化还原反应,产生Cr3+、Fe3+及H2O,反应的离子方程式为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O,10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水中含有CrO42-的物质的量n(CrO42-)=1.5×10-3 mol·L-1×10 ×103 L=15 mol,则根据反应方程式可知需消耗绿矾的质量m(FeSO47H2O)=15 mol ×3×278 g/mol=12510 g=12.51 kg。

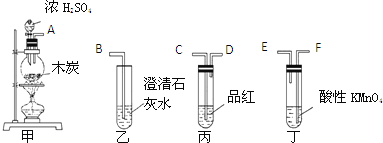
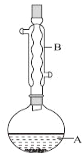
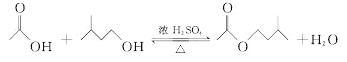
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______________。
(2)在洗涤操作中,第一次水洗的主要目的是___________,第二次水洗的目的是______________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水![]() 的目的是_________________。
的目的是_________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是__________(填标号)。
a. 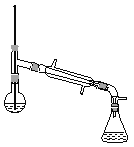 b.
b. 
c.  d.
d. 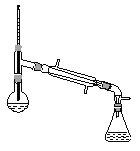
(7)本实验的产率是___________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏___________(填“高”或“低”),其原因是____________________。