题目内容
【题目】氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )
A. 氧化产物为N2
B. 该反应NH3被还原
C. 该反应HCl是还原产物
D. 生成1 mol N2有6 mol电子转移
【答案】B
【解析】
A和B.反应中氮元素化合价又-3价升高到0价,则反应中NH3被氧化,氧化产物为N2,故A正确,B错误;
C.氯元素的化合价由0价降低到-1价,发生还原反应,还原产物为HCl,故C正确;
D.氮元素化合价由-3价升高到0价,则生成1 mol N2时有6 mol电子转移,选项D正确。
故选B。

【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)②、⑤、⑥的离子半径由大到小的顺序为
(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式 ,
写出该化合物跟⑧的单质发生置换反应的化学方程式 .
(3)元素⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式
(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小.在一定条件下,将2L 甲气体与1.5L 乙气体均匀混合,若该混合气体被足量NaOH 溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是 .
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. AB. BC. CD. D
【题目】一同学用某种粗盐进行提纯实验,步骤见下图.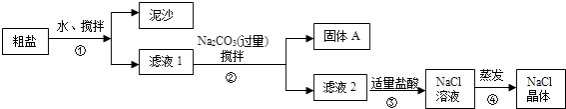
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 , 当蒸发皿中有较多量固体出现时,应 , 用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
| 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 | 取少量固体A于试管中,先滴入 , 再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, |
| 猜想Ⅲ成立 |
