��Ŀ����
����Ŀ��������ʾ�������ڳ�ʪ�����е�Ư����������O2������Cl2�������Ư�ۼ��Ⱥ�����ӦCa(ClO)2![]() CaCl2 + O2����
CaCl2 + O2����
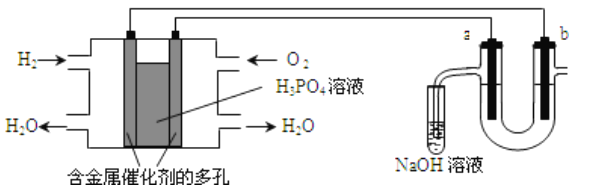
ѧ����������ͼװ�ý���ʵ�飺����A���Թ���װ�еij�ʪƯ����Ʒʱ���۲쵽B���д������ݲ�����
��1��B�з�����Ӧ�����ӷ���ʽΪ__________________________________________________��
��2����д��ʵ���Ҽ��������ķ�����_____________________________________________��
ѧ�������ʵ��ⶨij����Ư����Ʒ�д�����Ƶİٷֺ�����ʵ�鲽�����£�
������������������ΪW1g��
�������м�����Ʒ���ٳƣ�����ΪW2g��
���ظ����м��ȡ���ȴ��������ֱ�����أ�����ΪW3g��
��3������������������Ϊ_____________________��ʵ�鵽����ص��ж�������___________________________________________________��
��4����Ư����Ʒ�д�����Ƶİٷֺ���Ϊ_________________����W1��W2��W3��ʾ���������������ڱ�մ�������ֽ�����ʣ����ʵ���õĽ��__________________����ѡ����ƫ��������ƫС��������Ӱ������
���𰸡� Cl2+2OH�� =Cl��+ClO��+H2O ��ʪ���KI������ֽ���飬����ֽ������˵�������� ������ƽ �������μ��ȡ���ȴ�������Ľ�������0.001g ![]() ƫ��
ƫ��
������������������������Ϣ��֪�������ڳ�ʪ�����е�Ư����������O2������Cl2������B�з��������������������������Ȼ��ơ��������ƺ�ˮ�ķ�Ӧ��ʵ���Ҽ����������Բ���ʪ���KI������ֽ���飬����ֽ������˵���������������Ư�ۼ��Ⱥ�����ӦCa(ClO)2![]() CaCl2 + O2������������ʱ����ʹ�õ�����ƽ��ʵ�鵽����صı����������μ��ȡ���ȴ�������Ľ�������0.001g������Ca(ClO)2
CaCl2 + O2������������ʱ����ʹ�õ�����ƽ��ʵ�鵽����صı����������μ��ȡ���ȴ�������Ľ�������0.001g������Ca(ClO)2![]() CaCl2 + O2����֪�����������غ�����������������ٵ�����ΪO2�����������ݷ�Ӧǰ����������Ϸ�Ӧ����ʽ���Եó�Ư����Ʒ�д�����Ƶİٷֺ����������������ڱ�մ�������ֽ�����ʣ�������������ƫ��ʵ���õĴ�����Ƶİٷֺ���ƫ����
CaCl2 + O2����֪�����������غ�����������������ٵ�����ΪO2�����������ݷ�Ӧǰ����������Ϸ�Ӧ����ʽ���Եó�Ư����Ʒ�д�����Ƶİٷֺ����������������ڱ�մ�������ֽ�����ʣ�������������ƫ��ʵ���õĴ�����Ƶİٷֺ���ƫ����
�����(1). ��ʪƯ����������O2������Cl2��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��ˮ���÷�Ӧ�����ӷ���ʽΪ��Cl2��2OH��=Cl����ClO����H2O���ʴ�Ϊ��Cl2��2OH��=Cl����ClO����H2O��
(2). ʵ���Ҽ��������ij��÷���Ϊ����ʪ���KI������ֽ���飬����ֽ������˵�����������ʴ�Ϊ����ʪ���KI������ֽ���飬����ֽ������˵����������
(3). ��������ʱ���õ������ǵ�����ƽ��ʵ��ﵽ���صı����������μ��ȡ���ȴ�������Ľ�������0.001g���ʴ�Ϊ��������ƽ���������μ��ȡ���ȴ�������Ľ������0.001g��
(4). ����Ư����Ʒ������Ϊ(W2��W1)g�����������غ�����O2������Ϊ(W2��W3)g���ɷ���ʽCa(ClO)2![]() CaCl2 + O2����֪��Ca(ClO)2������Ϊ
CaCl2 + O2����֪��Ca(ClO)2������Ϊ![]() g�����Ư����Ʒ�д�����Ƶİٷֺ���Ϊ
g�����Ư����Ʒ�д�����Ƶİٷֺ���Ϊ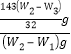 =
= ![]() �������������ڱ�մ�������ֽ�����ʣ�������������ƫ��ʵ���õĴ�����Ƶİٷֺ���ƫ�ʴ�Ϊ��
�������������ڱ�մ�������ֽ�����ʣ�������������ƫ��ʵ���õĴ�����Ƶİٷֺ���ƫ�ʴ�Ϊ��![]() ��ƫ��
��ƫ��

 ��У����ϵ�д�
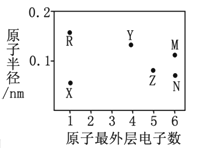
��У����ϵ�д�����Ŀ����֪����ø�ijɷ�Ϊ�����ʣ��ɽ����۷ֽ�Ϊ�����ǡ����������Ʋ�(����)
��Һ | ˫�����Լ� | ��Һ | ����Լ� |
�� | �� | �� | �� |
�� | �� | ���� | �� |
�ס��һ�� | �� | �� | �� |
ע����������ɫ������������ɫ�������������ɫ��
A. ����Һ���е��� B. ����Һ���л�ԭ����
C. �����Һ�������� D. �����Һ���е���ø
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol/L��4��������ҺpH���£�
���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
����˵������ȷ����
A. ������Һ�У�Na2CO3��Һ��ˮ�ĵ���̶����
B. NaHSO3��Һ�����Ե�ԭ���ǣ�����̶ȴ���ˮ��̶�
C. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH��С����H2SO3
D. ����ˮ�м�������Na2CO3(s)������������ˮ�д������Ũ��