题目内容
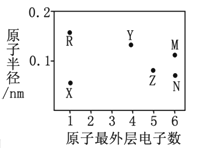
【题目】X、Y、Z、R、M、N为六种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
(1)M元素的原子核外有__________种能量不同的电子,有__________个未成对电子;Z元素在元素周期表中的位置是第______周期________族。
(2)N、R、X三种元素的原子可构成一种强碱性物质,该物质的电子式是_____________;Y元素的氧化物是制造光纤的主要材料,该氧化物是________晶体(填晶体类型)。
某化工生产的核心环节的反应为:2MN2(g) + N2(g) 2 MN3(g) + Q(Q>0)
(3)该反应的平衡常数表达式K=__________________________;欲使K值变大,可采取的措施是__________________________。
(4)该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则平衡____________________。(选填“正向移动”、“逆向移动”或“不移动”)
【答案】 5 2 二 ⅤA ![]() 原子 [SO3]2/{ [SO2]2·[O2] } 降温 逆向移动
原子 [SO3]2/{ [SO2]2·[O2] } 降温 逆向移动
【解析】分析:X、Y、Z、R、M、N为六种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M、N最外层有6个电子,位于第VIA族;R元素的原子半径最大,为Na元素,X元素的原子半径最小,为H元素;M元素的原子半径大于N,则M为S元素、N为O元素;Z的原子半径与N接近且大于N小于M,则Z为N元素,Y的原子半径大于M且小于R,则Y为Si元素。
详解:(1). S是16号元素,基态原子核外电子排布式为1s22s22p63s23p4,根据核外电子排布式可知,S原子有5种能量不同的电子,有2个未成对电子;N元素在元素周期表中的位置是第二周期ⅤA族,故答案为:5;2;二;ⅤA;
(2). O、Na、H三种元素构成的一种强碱性物质为NaOH,电子式为![]() ,Si元素的氧化物是SiO2,SiO2是制造光纤的主要材料,该氧化物是原子晶体,故答案为:
,Si元素的氧化物是SiO2,SiO2是制造光纤的主要材料,该氧化物是原子晶体,故答案为:![]() ;原子;
;原子;
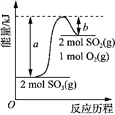
(3). 某化工生产的核心环节的反应为:2SO2(g) + O2(g) 2 SO3(g) + Q(Q>0),由反应方程式可知,该反应的平衡常数表达式K=[SO3]2/{ [SO2]2·[O2] };因该反应为放热反应,欲使K值变大,可采取的措施是降温,故答案为:[SO3]2/{ [SO2]2·[O2] };降温;
(4). 该反应达到平衡后,在其他条件不变的情况下,若使容器的体积扩大为原来的两倍,则容器的压强减小,因减小压强平衡向气体增多的方向移动,所以该反应平衡逆向移动,故答案为:逆向移动。