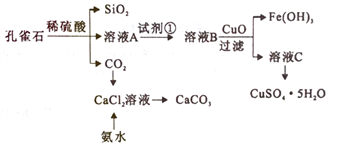
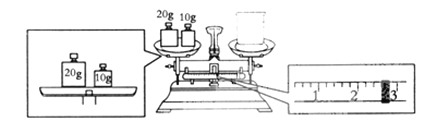
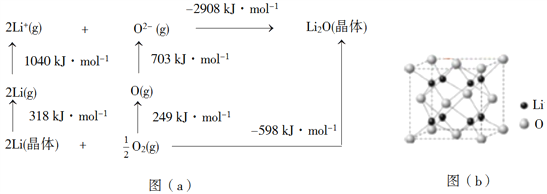
��Ŀ����
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol/L��4��������ҺpH���£�
���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
����˵������ȷ����
A. ������Һ�У�Na2CO3��Һ��ˮ�ĵ���̶����
B. NaHSO3��Һ�����Ե�ԭ���ǣ�����̶ȴ���ˮ��̶�
C. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH��С����H2SO3
D. ����ˮ�м�������Na2CO3(s)������������ˮ�д������Ũ��
���𰸡�D
��������������ͬŨ�ȵ�������ҺpH��С֪���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-��A����ͬŨ�ȵ��⼸��������Һ�У���ҺpHԽ����ˮ�ĵ���̶�Խ���ݱ�������֪��ˮ�ĵ���̶�������̼������Һ��ѡ��A��ȷ��B��������������Һ�����ԣ�˵��HSO3-����̶ȴ���ˮ��̶ȣ�������������������������Ӳ��ֵ��룬NaHSO3=Na++HSO3-��HSO3-![]() H++SO32-��ѡ��B��ȷ��C���������ˮ��̶�Խ�����������Խ�����������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-�����Գ����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������HClO��Һ��pH��С����H2SO3��ѡ��C��ȷ��D���������̼���Ʒ�Ӧ����̼�����ƺʹ���������ʹ���ɵĴ������Ũ�ȼ�С��ѡ��D����ȷ����ѡD��
H++SO32-��ѡ��B��ȷ��C���������ˮ��̶�Խ�����������Խ�����������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-�����Գ����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������HClO��Һ��pH��С����H2SO3��ѡ��C��ȷ��D���������̼���Ʒ�Ӧ����̼�����ƺʹ���������ʹ���ɵĴ������Ũ�ȼ�С��ѡ��D����ȷ����ѡD��

 ��У����ϵ�д�
��У����ϵ�д�