题目内容
取a g某铁的氧化物R溶于足量稀盐酸,加水稀释至200mL,取20mL所得溶液,向其中滴加新制氯水,将其中的铁元素全部氧化为Fe3+,再向溶液中加入NaOH溶液使其完全沉淀,所得沉淀经过滤、洗涤,并将沉淀灼烧至质量不再变化,称量得b g固体,则( )
| A、若a:b=10:3,则R的化学式为Fe2O3 | ||
| B、若a:b=29:3,则R的化学式为Fe3O4 | ||
| C、若a:b=9:32,则R的化学式为FeO | ||
D、实验过程中被还原的Cl2为
|
考点:化学方程式的有关计算
专题:计算题
分析:20mL溶液相当于溶解铁的氧化物整理ag×
=0.1a,灼烧最终得到bg固体为Fe2O3,令原Fe氧化物的物质的量为n mol,根据Fe元素守恒计算氧化铁的物质的量,根据m=nM表示选项中各氧化物的质量、氧化铁的质量,进而确定a:b的关系,据此验证判断;
最终得到氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,据此计算通入氯气的物质的量.
| 20mL |
| 200mL |
最终得到氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,据此计算通入氯气的物质的量.
解答:
解:20mL溶液相当于溶解铁的氧化物ag×
=0.1a,
A.若R的化学式为Fe2O3,经过系列变化又得到到Fe2O3,则:0.1a=b,故a:b=10:1,故A错误;
B.若R的化学式为Fe3O4,经过系列变化又得到Fe2O3,设0.1a g Fe3O4的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=
mol,则:232n=0.1a,160×
=b,整理的a:b=29:3,故B正确;
C.若R的化学式为FeO,经过系列变化又得到Fe2O3,设0.1a g FeO的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=0.5n mol,则:72n=0.1a,160×0.5n=b,整理的a:b=9:1,故C错误;
D.最终氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,而1mol氯气获得的电子等于1molO原子获得的电子,故被还原氯气物质的量=n(O)=
=
mol,故D正确,
故选BD.
| 20mL |
| 200mL |
A.若R的化学式为Fe2O3,经过系列变化又得到到Fe2O3,则:0.1a=b,故a:b=10:1,故A错误;
B.若R的化学式为Fe3O4,经过系列变化又得到Fe2O3,设0.1a g Fe3O4的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=
| 3n |
| 2 |
| 3n |
| 2 |
C.若R的化学式为FeO,经过系列变化又得到Fe2O3,设0.1a g FeO的物质的量为n mol,由Fe原子守恒可知,Fe2O3的物质的量=0.5n mol,则:72n=0.1a,160×0.5n=b,整理的a:b=9:1,故C错误;
D.最终氧化铁质量与原铁的氧化物质量之差=(b-a)g,为O元素质量,根据电子转移守恒可知,O原子获得的电子等于氯气获得电子,而1mol氯气获得的电子等于1molO原子获得的电子,故被还原氯气物质的量=n(O)=
| (b-a)g |
| 16g/mol |
| 10b-a |
| 16 |
故选BD.
点评:本题考查化学计算,侧重考查学生分析解决问题的能力,利用验证法进行判断比较简单,也可以计算铁氧化物中Fe、O质量确定化学式,但比较麻烦,D选项为易错点,注意根据电子转移守恒解答.

练习册系列答案
相关题目
分别取等物质的量浓度的NaOH溶液各100mL,再通入一定量的CO2随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):下列说法正确的是( )


| A、在A情况下,溶质是NaOH和Na2CO3的混合物,其物质的量之比为2:1 |
| B、在B情况下,溶质是Na2CO3和NaHCO3的混合物,其物质的量之比为1:2 |
| C、在B情况下,溶质只有Na2CO3 |
| D、原NaOH溶液的物质的量浓度为1.5 mol/L |
下列各组物质分别在空气中充分燃烧,产物完全相同的是( )
| A、H2和CO |
| B、C和CO |
| C、CO和CH4 |
| D、H2和C |
向含0.28mol Na2CO3的溶液中逐滴加入一定量的稀盐酸,充分反应后,溶液中各溶质的物质的量判断可能正确的是( )
| A、剩0.08mol Na2CO3,得0.40mol NaCl |
| B、得0.40mol NaCl和0.16mol NaHCO3 |
| C、剩0.12mol HCl,得0.28mol NaCl和0.28mol NaHCO3 |
| D、得0.12mol NaCl和0.16mol NaHCO3 |
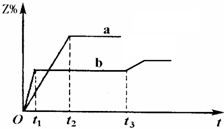 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )| A、曲线a是500℃时的图象 |
| B、t3时刻可能是降低了温度 |
| C、正反应是吸热反应 |
| D、t3时刻可能是增大了压强 |
常温下,将a mL b mol/L CH3COOH溶液加入到c mL d mol/L NaOH溶液中.下列结论中,不正确的是( )
| A、如果ab=cd,则反应后溶液的pH>7 |
| B、如果a=c,且反应后溶液的pH<7,则b<d |
| C、如果a=c、b=d,则反应后的溶液中c(CH3COO-)<c(Na+) |
| D、如果反应后溶液的pH=7,则此溶液中c(CH3COO-)=c(Na+) |
分子式为C8H10且苯环上有两个侧链的有机物有多种,这些有机物的一氯取代物一共有( )
| A、10种 | B、9种 | C、6种 | D、5种 |
常温下,下列各溶液的叙述中正确的是( )
| A、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,c(Na+)-c(F-)<c(K+)-c(CH3COO-) |
| B、0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b |
| C、相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| D、氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):C(SO42-)=1:1 |
某软质隐形眼镜材料为如图所示的聚合物.下列有关说法错误的是( )
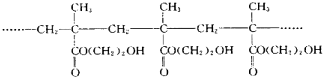

| A、生成该聚合物的反应属于加聚反应 |
| B、该聚合物的单体是丙酸乙酯 |
| C、该聚合物分子中存在大量的-OH,所以具有较好的亲水性 |
D、该聚合物的结构筒式为: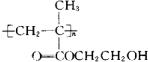 |