题目内容
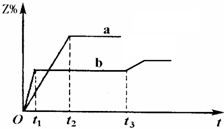 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )| A、曲线a是500℃时的图象 |
| B、t3时刻可能是降低了温度 |
| C、正反应是吸热反应 |
| D、t3时刻可能是增大了压强 |
考点:产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:根据“先拐先平数值大”知,a的温度小于b;升高温度,Z的含量减小,说明正反应是放热反应;t3时刻,Z的含量增大,平衡向正反应方向移动,可以采用降低温度、减小压强的方法.
解答:
解:A.根据“先拐先平数值大”知,a的温度小于b,所以曲线a是300℃时的图象,故A错误;
B.a的温度小于b,升高温度,Z的含量减小,说明正反应是放热反应,t3时刻改变条件,Z的含量增大,平衡向正反应方向移动,所以可能是降低了温度或减小压强,故B正确;
C.a的温度小于b,升高温度,Z的含量减小,说明正反应是放热反应,逆反应是吸热反应,故C错误;
D.如果t3时刻增大压强,则平衡向逆反应方向移动,Z的含量减小,实际上Z的含量增大,所以可能是减小了压强,故D错误;
故选B.
B.a的温度小于b,升高温度,Z的含量减小,说明正反应是放热反应,t3时刻改变条件,Z的含量增大,平衡向正反应方向移动,所以可能是降低了温度或减小压强,故B正确;
C.a的温度小于b,升高温度,Z的含量减小,说明正反应是放热反应,逆反应是吸热反应,故C错误;
D.如果t3时刻增大压强,则平衡向逆反应方向移动,Z的含量减小,实际上Z的含量增大,所以可能是减小了压强,故D错误;
故选B.
点评:本题考查了产物百分含量与温度、压强的关系,根据曲线变化趋势与温度的关系、压强的关系分析解答,题目难度不大.

练习册系列答案
相关题目
在实验室中,下列除去杂质的方法正确的是( )
| A、溴苯中混有溴,加入KI溶液,振荡,再用汽油萃取 |
| B、硝基苯中混有浓硝酸和浓硫酸,将其倒入到NaOH溶液中,静置,分液 |
| C、乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 |
| D、乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气 |
光具有能量,能影响很多反应.下列反应中,受光照影响显著的是( )
| A、乙醇与乙酸的酯化反应 |
| B、甲烷与氧气的反应 |
| C、铁与氯气的反应 |
| D、次氯酸的分解 |
下列各组离子,在pH=0的溶液中可以大量共存的是( )
| A、Al3+、S2-、Br-、SO32- |
| B、Mg2+、Cu2+、SO42-、Br- |
| C、Na+、Fe2+、I-、MnO4- |
| D、NH4+、K+、HS-、Cl- |
取a g某铁的氧化物R溶于足量稀盐酸,加水稀释至200mL,取20mL所得溶液,向其中滴加新制氯水,将其中的铁元素全部氧化为Fe3+,再向溶液中加入NaOH溶液使其完全沉淀,所得沉淀经过滤、洗涤,并将沉淀灼烧至质量不再变化,称量得b g固体,则( )
| A、若a:b=10:3,则R的化学式为Fe2O3 | ||
| B、若a:b=29:3,则R的化学式为Fe3O4 | ||
| C、若a:b=9:32,则R的化学式为FeO | ||
D、实验过程中被还原的Cl2为
|
下列离子方程式正确的是( )
| A、NaHCO3的水解:HCO3-+H2O═H3O++CO32- |
| B、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
| C、1mol Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 |
| D、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
下列说法正确的是( )
| A、光导纤维的材料是晶体硅 |
| B、金属越活泼,发现和使用的年代越早 |
| C、合理使用化肥有利于提高农作物产量 |
| D、高毒、高效、高残留化合物可用作未来粮食生产的杀虫剂 |
下列有关溶液中离子浓度的关系,不正确的是( )
| A、NaHC03溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B、常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C、0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D、相同温度下,0.2mol/L的CH3COOH溶液中c(H+)小于0.1mol/L的CH3COOH中c(H+)的两倍 |