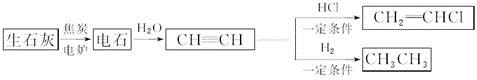
题目内容
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式
A___________,C_______________,E______________,F_________________。
(2)E的浓溶液与Cu应的化学方程式是______________________________________________________;该反应中氧化剂与还原剂的物质的量之比为____________;该反应的还原产物与少量B溶液反应的离子方程式是_____________________________________________________________________________。
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象_____________________________。
(共9分)(1) NH3·H2O (1分) BaCl2 (1分) H2SO4(1分) AgNO3(1分)
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (1分) 1:1 (1分)
CuSO4+SO2↑+2H2O (1分) 1:1 (1分)
H2O+2SO2 + CO32-=CO2↑ + 2HSO3―(1分)
(3)取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液(2分)
解析试题分析:纯E为无色油状液体,则E是硫酸。A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾,因此A是氨水。将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解,这说明F中含有Ag+,因此F可能是硝酸银。D中含有Al3+或Mg2+。将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出,说明B应该是碳酸盐。将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶,这说明C应该是氯化钡,D中含有SO42-。
(1)根据以上分析可知,A、C、E、F中溶质的化学式分别为H3·H2O、BaCl2、H2SO4、AgNO3。
(2)浓硫酸具有强氧化性,与铜反应的化学方程式为Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。该反应中还原剂是铜,化合价从0价升高到+2价。氧化剂是硫酸,S元素化合价从+6价降低到+4价,则根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为1:1;其中还原产物是SO2,由于亚硫酸的酸性强于碳酸的,所以SO2与少量B溶液反应的离子方程式是H2O+2SO2+CO32-=CO2↑+ 2HSO3―。
CuSO4+SO2↑+2H2O。该反应中还原剂是铜,化合价从0价升高到+2价。氧化剂是硫酸,S元素化合价从+6价降低到+4价,则根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为1:1;其中还原产物是SO2,由于亚硫酸的酸性强于碳酸的,所以SO2与少量B溶液反应的离子方程式是H2O+2SO2+CO32-=CO2↑+ 2HSO3―。
(3)要进一步确定D中阳离子,可以利用氢氧化铝的两性进行判断,即取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液。
考点:考查物质的推断、离子检验,氧化还原反应的有关判断与计算等

下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ?mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ?mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)
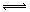 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的活泼性比Y的 (填“强”或“弱”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2的电子式 ,XY2的结构式 。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称 。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式 。
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
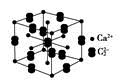
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。