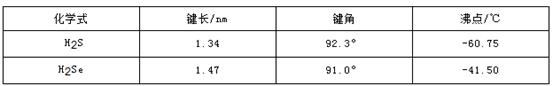
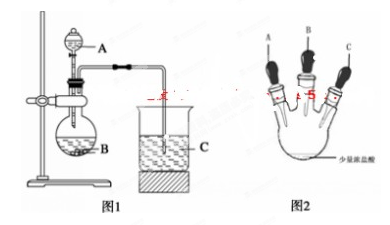
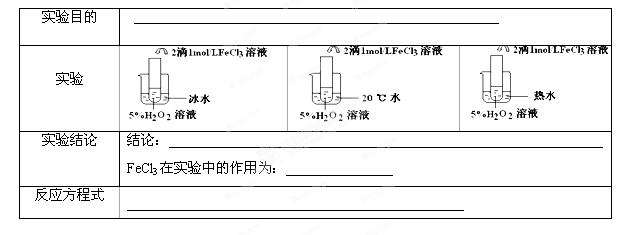
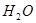题目内容
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。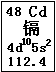
请回答下列问题:
(1)镉元素的原子序数为 ,在元素周期表中的位置是 。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论? 。
(3)你认为“毒大米”中镉的来源是什么? 。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O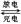 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是 。
负极的电极反应式为 。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA= 。
(9分) (1)48(1分) 第五周期第ⅡB族(1分)
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害。(1分)
(3)工业生产造成了土壤的镉污染,富集在大米中(1分)
(4)Cd(镉)(1分) Cd-2e—+2OH—=Cd(OH)2(2分)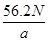 mol—1(2分)
mol—1(2分)
解析试题分析:(1)镉元素在元素周期表中的图示可知,镉元素的原子序数为48,在元素周期表中的位置是第五周期第ⅡB族。
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害,所以这种说法是错误的。
(3)“毒大米”中镉的来源是工业生产造成了土壤的镉污染,富集在大米中。
(4)放电相当于是原电池,原电池中负极失去电子,化合价升高,发生氧化反应。所以根据化学方程式可知,该电池的负极是Cd,负极电极反应式是Cd-2e—+2OH—=Cd(OH)2。agCd的物质的量是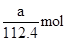 ,在反应中失去
,在反应中失去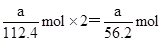 电子,所以阿伏加德罗常数NA=
电子,所以阿伏加德罗常数NA=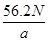 mol—1。
mol—1。
考点:考查元素周期表的结构、原电池的有关判断、电极反应式的书写和计算
点评:该题以近期曝出的“毒大米”事件为载体,重点考查学生对元素周期表结构、原电池原理以及灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的环境保护意识,增强学生的社会责任感。

 小学能力测试卷系列答案
小学能力测试卷系列答案一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。 下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。

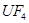 +
+ 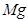 ——
——  +
+ 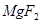
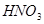 ——
—— 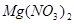 +
+ 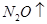 +
+