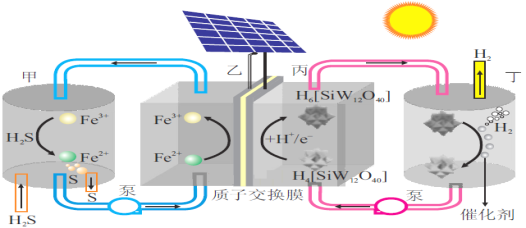
题目内容
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如图所示,下列说法正确的是( )
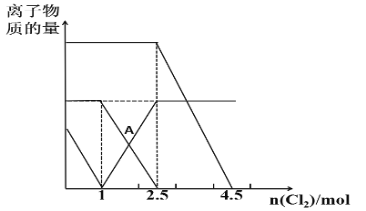
A.三种离子的还原性强弱关系是:Br->Fe2+>I-
B.A点表示Fe2+正好反应了一半
C.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3
D.当通入2.5molCl2时,溶液中已发生的离子反应可表示为:6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
【答案】BD
【解析】
首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象,判断参加反应的各离子的物质的量,以此解答该题。
A. 在2Fe2++Br2=2Fe3++2Br-反应中,Fe2+作还原剂,还原剂的还原性>还原产物的还原性,,在2Fe3++2I-=2Fe2++I2反应中,I-作还原剂,根据还原剂的还原性>还原产物的还原性,则还原性:I->Fe2+>Br-,A错误;
B. 在通入氯气的量为0~1mol的过程中,I-先被氧化;通入氯气的量为1~2.5mol的过程中,Fe2+被氧化,Fe3+的量逐渐增大,同时Fe3+与I-反应生成Fe2+和I2,A点表示Fe2+正好反应了一半,B正确;
C. 通入氯气的量为0~1mol的过程中,I-先被氧化,发生2I-+Cl2=I2+2Cl-,则n(I-)=2mol,通入氯气的量为1~2.5mol的过程中,Fe2+被氧化,2Fe2++Cl2=2Fe3++2Cl-,n(Fe2+)=3mol,
通入氯气的量为2.5~4.5mol的过程中,Br-被氧化,2Br-+Cl2= Br2+2Cl-,n(Br-)=4mol,所以n(Fe2+)︰n(I-)︰n(Br-)=3︰2︰4,C错误;
D. 当通入2.5molCl2时,溶液中已经发生:2I-+Cl2=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-和2Fe3++2I-=2Fe2++I2,可表示为:6Fe2++4I-+5Cl2=
6Fe3++2I2+10Cl-,D正确;故答案为:BD。

 阅读快车系列答案
阅读快车系列答案