题目内容
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。
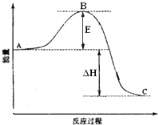
(已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ·mol-1。)请回答下列问题:
(1)图中A、C分别表示____、____,E的大小对该反应的反应热____(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“变大”、“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式____。
(4)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的ΔH=____。
【答案】反应物能量 生成物能量 无影响 降低 -198kJ/mol SO2+V2O5=SO3+2VO2;4VO2+O2=2V2O5 -1185kJ/mol
【解析】
(1)1molSO2(g)氧化为1molSO3(g)的△H=-99kJmol-1,说明反应2SO2(g)+O2(g)=2SO3(g)为放热反应,则反应物总能量大于生成物总能量,加入催化剂,反应热不变;
(2)根据方程式计算反应热;
(3)根据反应物和生成物确定反应的方程式;
(4)根据燃烧热的定义计算反应热。
(1)图中A、C分别表示反应物总能量和生成物总能量。1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,说明反应2SO2(g)+O2(g)=2SO3(g)为放热反应,则反应物总能量大于生成物总能量,E为活化能,反应热为活化能之差,活化能对反应热无影响,加入催化剂,活化能降低,但不能改变反应物的总能量和生成物的总能量之差,反应热不变;
(2)已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198kJmol-1;
(3)V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5,相关反应为SO2+V2O5=SO3+2VO2、4VO2+O2=2V2O5;
(4)单质硫的燃烧热为296kJmol-1,则由S(s)生成1molSO3(g)的△H=-296kJmol-1-99kJmol-1=-395 kJmol-1,则由S(s)生成3molSO3(g)的ΔH=-395 kJmol-1×3=-1185kJ/mol。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】可用下面示意图表示的是
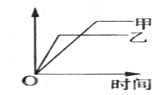
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2molSO2和1molO2 | 2molSO2和2molO2 |
B | 2molSO2与1molO2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106Pa | 1×105Pa |
C | 相同质量氨,在同一固定容积容器中反应 | 氨气的浓度 | 400℃ | 500℃ |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A.AB.BC.CD.D