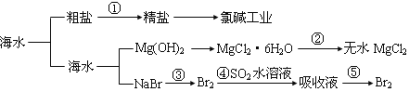
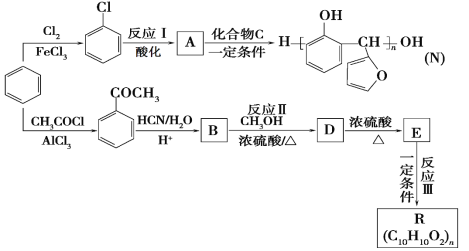
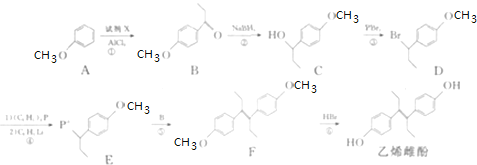
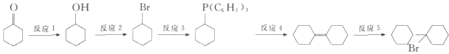
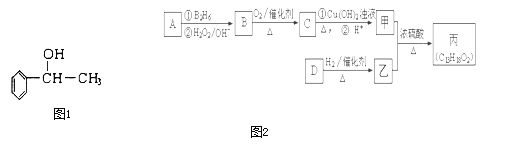
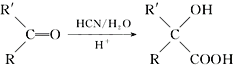ћвƒњƒЏ»Ё
°Њћвƒњ°њA°ҐB°ҐC°ҐD°ҐEЊщќ™ґћ÷№∆Џ‘™ЋЎ£ђ‘≠„”–т э“јіќ‘ціу£ђ«лЄщЊЁ±н÷––≈ѕҐїЎірѕ¬Ѕ–ќ ћв£Ї
‘™ЋЎ | ‘™ЋЎ–‘÷ їтљбєє |
A | „оЌв≤гµз„” э «∆дƒЏ≤гµз„” эµƒ2±ґ |
B | B‘™ЋЎµƒµ•÷ ‘Џњ’∆ш÷–ЇђЅњ„оґа |
C | C‘™ЋЎ‘ЏµЎњ«÷–ЇђЅњ„оґа |
D | D‘™ЋЎ‘ЏЌђ÷№∆Џ÷–љр ф–‘„о«њ |
E | ≥£ќ¬≥£—єѕ¬£ђE‘™ЋЎ–ќ≥…µƒµ•÷ «µ≠ї∆…Ђєћће£ђ≥£‘Џїр…љњЏЄљљь≥Ѕїэ |
£®1£©E‘Џ‘™ЋЎ÷№∆Џ±н÷–µƒќї÷√___£Ѓ
£®2£©B„оЉтµ•∆шћђ«вїѓќпµƒµз„” љ___£ђ ф”Џ____їѓЇѕќп£®ћо°∞јл„”°±їт°∞є≤Љџ°±£©£їDµƒ„оЄяЉџ—хїѓќпµƒЋЃїѓќпµз„” љ___£ђЋщЇђїѓ—ІЉьја–Ќ£Ї___£Ѓ
£®3£©B°ҐC°ҐD°ҐEЉтµ•јл„”∞лЊґ”…іуµљ–°Ћ≥–тќ™£Ї ____£®ћојл„”ЈыЇ≈£©£Ѓ
£®4£©”√µз„” љ±н ЊEµƒ«вїѓќпµƒ–ќ≥…єэ≥ћ_____£Ѓ
£®5£©”…A°ҐB°ҐC”л«в‘™ЋЎ„й≥…µƒ“ї÷÷≥£ЉыЋб љ—ќ”лєэЅњDµƒ„оЄяЉџ—хїѓќпµƒЋЃїѓќпЈі”¶µƒјл„”Јљ≥ћ љ£Ї___£Ѓ
°Њір∞Є°њµЏ3÷№∆ЏVIA„е ![]() є≤Љџ
є≤Љџ ![]() јл„”ЉьЇЌє≤ЉџЉь S2-£ЊN3-£ЊO2-£ЊNa+
јл„”ЉьЇЌє≤ЉџЉь S2-£ЊN3-£ЊO2-£ЊNa+ ![]() NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O
NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O
°Њљвќц°њ
A°ҐB°ҐC°ҐD°ҐEЊщќ™ґћ÷№∆Џ‘™ЋЎ£ђ‘≠„”–т э“јіќ‘ціу°£A„оЌв≤гµз„” э «∆дƒЏ≤гµз„” эµƒ2±ґ£ђ‘тAќ™ћЉ‘™ЋЎ£їB‘™ЋЎµƒµ•÷ ‘Џњ’∆ш÷–ЇђЅњ„оґа£ђ‘тBќ™µ™‘™ЋЎ£їC‘™ЋЎ‘ЏµЎњ«÷–ЇђЅњ„оґа£ђ‘тCќ™—х‘™ЋЎ£їD‘™ЋЎ‘ЏЌђ÷№∆Џ÷–љр ф–‘„о«њ£ђ‘тDќ™ƒ∆‘™ЋЎ£ї≥£ќ¬≥£—єѕ¬£ђE‘™ЋЎ–ќ≥…µƒµ•÷ «µ≠ї∆…Ђєћће£ђ≥£‘Џїр…љњЏЄљљь≥Ѕїэ£ђ‘тEќ™Ѕт‘™ЋЎ°£
£®1£©S‘™ЋЎ‘Џ‘™ЋЎ÷№∆Џ±н÷–µƒќї÷√ «µЏ3÷№∆ЏVIA„е°£
£®2£©B„оЉтµ•∆шћђ«вїѓќп «NH3£ђ∆дµз„” љќ™![]() £ђ ф”Џє≤ЉџїѓЇѕќп£їDµƒ„оЄяЉџ—хїѓќпµƒЋЃїѓќп «NaOH£ђ∆дµз„” љќ™
£ђ ф”Џє≤ЉџїѓЇѕќп£їDµƒ„оЄяЉџ—хїѓќпµƒЋЃїѓќп «NaOH£ђ∆дµз„” љќ™![]() £ђ∆д÷–Їђјл„”ЉьЇЌє≤ЉџЉь°£
£ђ∆д÷–Їђјл„”ЉьЇЌє≤ЉџЉь°£
£®3£©B°ҐC°ҐD°ҐEЉтµ•јл„”Ј÷±рќ™N3-°ҐO2-°ҐNa+°ҐS2-£ђS2-”–3Єцµз„”≤г£ђ∆дЋыЉЄ÷÷јл„”÷ї”–2Єцµз„”≤г£ђµз„”≤гљбєєѕаЌђµƒјл„”£ђЇЋµзЇ… эљѕіуµƒ∞лЊґљѕ–°£ђє ∞лЊґ”…іуµљ–°Ћ≥–тќ™£Ї S2-£ЊN3-£ЊO2-£ЊNa+°£
£®4£©Eµƒ«вїѓќпќ™H2S£ђ”√µз„” љ±н Њ∆д–ќ≥…єэ≥ћќ™![]() °£
°£
£®5£©”…A°ҐB°ҐC”л«в‘™ЋЎ„й≥…µƒ“ї÷÷≥£ЉыЋб љ—ќќ™NH4HCO3£ђ∆д”лєэЅњNaOHЈі”¶µƒјл„”Јљ≥ћ љќ™NH4++HCO3-+2OH-=NH3H2O+CO32-+H2O°£