题目内容
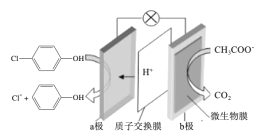
【题目】铜是生活中常见的金属,铜及其化合物在不同环境中能呈现出不同的颜色:
![]()
回答下列问题:
(1)Cu基态核外电子排布式为___;科学家通过X射线测得Cu(H2O)4SO4·H2O结构示意图可简单表示如图:
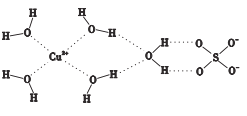
图中虚线表示的作用力为___。
(2)已知Cu+(SCN)2![]() Cu+(SCN)2,1mol(SCN)2分子中含有的π键数目为___,写出2个与SCN-互为等电子体的分子的化学式___。
Cu+(SCN)2,1mol(SCN)2分子中含有的π键数目为___,写出2个与SCN-互为等电子体的分子的化学式___。
(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(4)在Cu(H2O)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是___,其中心原子的杂化轨道类型是___。
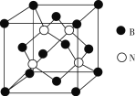
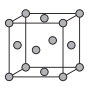
(5)已知Cu的晶胞结构如图所示,铜原子的配位数为___,又知晶胞边长为3.61×10-8cm,则Cu的密度为___ (保留三位有效数字)。
【答案】1s22s22p63s23p63d104s1 配位键、氢键 4NA CO2、CS2(其他答案正确即可) 过氧化氢为氧化剂,氨与铜离子形成配离子,两者相互促进使反应进行 Cu + H2O2 + 4NH3·H2O = Cu(NH3)4(OH)2+4H2O SO42 sp3 12 9.04g·cm3
【解析】
⑴Cu是29号元素,写出基态核外电子排布式;Cu2+与H2O中O之间是配位键,O提供孤对电子,H···O之间是分子间氢键。
⑵根据(SCN)2的结构式为N≡C—S—S—C≡N计算π键数目;根据价电子数S = O =N-分析,书写与SCN-互为等电子体的分子的化学式。
⑶金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能相互促进,其中过氧化氢为氧化剂,氨与铜离子形成配离子,两者相互促进使反应进行,再书写方程式。
⑷计算硫酸根的价层电子对数,得出中心原子的杂化轨道类型和结构。
⑸已知Cu的晶胞结构如图所示,Cu是面心立方,计算晶胞中Cu的个数和根据公式计算Cu的密度。
⑴Cu是29号元素,其基态核外电子排布式为1s22s22p63s23p63d104s1;科学家通过X射线测得Cu(H2O)4SO4·H2O结构示意图可简单表示如图:Cu2+与H2O中O之间是配位键,O提供孤对电子,H···O之间是分子间氢键;故答案为:1s22s22p63s23p63d104s1;配位键、氢键。
⑵(SCN)2的结构式为N≡C—S—S—C≡N,因此1mol(SCN)2分子中含有的π键数目为4NA,根据价电子数S = O =N-分析,与SCN-互为等电子体的分子的化学式CO2、CS2;故答案为:4NA;CO2、CS2(其他答案正确即可)。
⑶金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能相互促进,其中过氧化氢为氧化剂,氨与铜离子形成配离子,两者相互促进使反应进行,方程式可表示为Cu + H2O2 + 4NH3·H2O = Cu(NH3)4(OH)2+4H2O;故答案为:过氧化氢为氧化剂,氨与铜离子形成配离子,两者相互促进使反应进行;Cu + H2O2 + 4NH3·H2O = Cu(NH3)4(OH)2+4H2O。
⑷在Cu(H2O)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,S与四个O形成4个共价键,孤对电子数=![]() ,因此价层电子对数为4对,中心原子的杂化轨道类型为sp3杂化,呈正四面体结构;故答案为:SO42;sp3。
,因此价层电子对数为4对,中心原子的杂化轨道类型为sp3杂化,呈正四面体结构;故答案为:SO42;sp3。
⑸已知Cu的晶胞结构如图所示,Cu是面心立方,因此铜原子的配位数为12,又知晶胞边长为3.61×10-8cm,晶胞中Cu的个数为![]() ,则Cu的密度为
,则Cu的密度为 ;故答案为:12;9.04g·cm3。
;故答案为:12;9.04g·cm3。