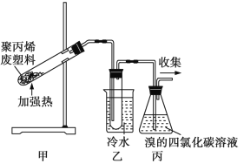
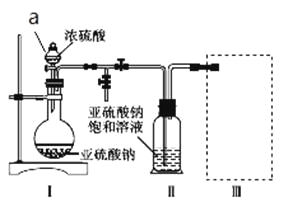
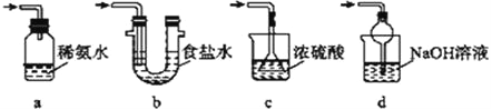
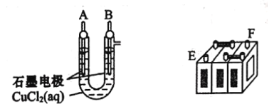
��Ŀ����
����Ŀ��������������ʹ�õ�ϡ�����������㷺Ӧ���ڵ��Ӳ�Ʒ�С������������������Ҫԭ������ϡ�������ϡ��������������Լ��������ʡ���ش��������⣺
(1)��(Nd)Ϊ60��Ԫ�أ���Ԫ�����ڱ���λ�ڵ�____���ڣ���̬Fe2����Χ���ӵĹ������ʽΪ_____________��
(2)ʵ����AlCl3��ʵ�ʴ�����ʽΪAl2Cl6������ӵ����ģ����ͼ��ʾ��

�ٸ÷�����Alԭ�Ӳ�ȡ______�ӻ���
��Al2Cl6�����NaOH��Һ��Ӧ����Na[Al(OH)4]��[Al(OH)4]���д��ڵĻ�ѧ����____�����ţ���
A�����Ӽ�����B�����Թ��ۼ�����C������������D���Ǽ��Թ��ۼ�����E�����
(3)FeO�����Ӿ��壬�侧���ܿ�ͨ�����µ�Born��Haberѭ������õ���

��̬Feԭ�ӵĵ�һ������Ϊ___kJ��mol-1��FeO�ľ�����Ϊ___kJ��mol-1��
(4)������к��д������Ϻ�����������ʴ�������������һ�����㣬��ͨ�������(Ni)�Ƚ��б���Ϳ�㴦������֪Ni�����γɻ��������ʻ�����Ni(CO)4�ݣ���Ϊ��ɫ�ӷ��綾Һ�壬�۵�Ϊ��25 �棬�е�Ϊ43 �棬������ˮ���������Ҵ����������Ȼ�̼���л��ܼ������ʻ����ľ���������_______��д�������廥Ϊ�ȵ�����ķ��Ӻ����ӵĻ�ѧʽΪ_____��_____����дһ�֣���
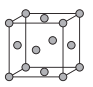
(5)��֪����BN����Ӳ�Ⱥܴ���ԭ����________���侧���ṹ��ͼ��ʾ���辧���������B��Nԭ��֮��ľ���Ϊa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ_____g��cm-3����ʽ���ɣ��ú�a��NA�Ĵ���ʽ��ʾ����

���𰸡��� ![]() sp3 B 762.5 3902 ���Ӿ��� N2 CN- ����BN������ԭ�Ӿ��壬B-N�����ܴ������ʵؼ�Ӳ
sp3 B 762.5 3902 ���Ӿ��� N2 CN- ����BN������ԭ�Ӿ��壬B-N�����ܴ������ʵؼ�Ӳ ![]()
��������
(1)NdΪ60��Ԫ�أ����ݸ��������а�����Ԫ��������Ŀ��Ԫ�����ڱ��ṹȷ�������ڵ�λ�ã����ݹ���ԭ����дFe2+��������Ų������ù������ʽ���
(2)��A12C16Ϊ˫�۷��ӽṹʽ������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ����ͣ�
��[Al(OH)4]����Al���Ӻ�Oԭ��֮�������λ����O-Hԭ��֮����ڼ��Լ�����λ��Ҳ���ڹ��ۼ���
(3)���ݵ�һ�����ܺ;����ܵĶ��壬���ͼʾ���ݽ��
(4)���ݾ���������ж��侧�����ͣ���ϵȵ����庬����д����CO��Ϊ�ȵ�����ķ��Ӻ����ӵĻ�ѧʽ��
(5)��֪����BN����Ӳ�Ⱥܴ�˵��ԭ��֮����������ǿ������ԭ�Ӿ��壬�þ�̯���������ܶȼ��㹫ʽ����NA��ֵ��
(1) NdΪ60��Ԫ�أ�����Ԫ�����ڱ��и������ڰ�����Ԫ��������Ŀ�ֱ���2��8��8��18��18��32��32����NdΪ�������ڵ�IIIB�壬Fe��26��Ԫ�أ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2����Fe2+��������Ų�Ϊ1s22s22p63s23p63d6���۲���ӵĹ������ʽΪ��![]() ��
��
(2)��A12C16Ϊ˫�۷��ӽṹʽ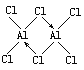 ������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ�����Ϊsp3�ӻ���
������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ�����Ϊsp3�ӻ���
��[Al(OH)4]����Al���Ӻ�Oԭ��֮�������λ����O-Hԭ��֮����ڼ��Լ�����λ��Ҳ���ڹ��ۼ����ʺ���ѡ����B��
(3)Feԭ�ӵĵ�һ������ΪFe(g)ԭ��ʧȥ1�������γ�Fe+(g)����Ҫ����������Fe�ĵ�һ������Ϊ��762.5 kJ/mol��FeO�������dz�Fe2+(g)��O2-(g)�γ�1 mol FeO�����ͷŵ�����������ͼʾ��֪FeO������Ϊ3902 kJ/mol��
(4)���������ʻ�����Ni(CO)4�ݣ���Ϊ��ɫ�ӷ��綾Һ�壬�۵�Ϊ-25�棬�е�Ϊ43�棬������ˮ���������Ҵ����������Ȼ�̼���л��ܼ���˵���乹����֮��������С�����з��Ӿ�����ص㣬�����ʻ����ľ��������Ƿ��Ӿ��壬���ʻ�����Ni(CO)4�ݵ���λ����CO������2��ԭ�ӣ���������Ϊ14�����Ը��ݵȵ�����ĺ����֪��CO��Ϊ�ȵ�����ķ���ΪN2������ΪCN-��
(5)����BN����Ӳ�Ⱥܴ���ԭ��������BN������ԭ�Ӿ��壬ԭ�Ӱ뾶С��B-N�����ܴ������ĺܸ����������ʵؼ�Ӳ���۷е�ߣ�
����BN����ṹ��֪����һ�������к��е�Nԭ����Ϊ��8��![]() +6��
+6��![]() =4�����е�Bԭ����ĿΪ4��1=4����һ�������к���4��BN�������������B��Nԭ��֮��ľ���Ϊa nm���þ�����ھ�����Խ��߳��ȵ�
=4�����е�Bԭ����ĿΪ4��1=4����һ�������к���4��BN�������������B��Nԭ��֮��ľ���Ϊa nm���þ�����ھ�����Խ��߳��ȵ�![]() ��������Խ��߳���=4a nm�������ⳤ=
��������Խ��߳���=4a nm�������ⳤ=![]() nm���������ΪV=(
nm���������ΪV=(![]() nm)3=(
nm)3=(![]() ��10-7cm)3�������ӵ�������ֵΪNA����=
��10-7cm)3�������ӵ�������ֵΪNA����=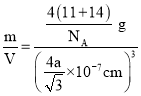 =
=![]() g/cm3��
g/cm3��

 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�