题目内容
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
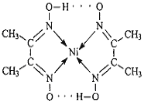
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
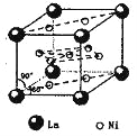
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
【答案】分子 3d84s2 7 ACE ①③④ 平面三角 LaNi5 小于
【解析】
(1)熔沸点低的晶胞为分子晶体;Ni核电荷数为28,根据构造原理写出价电子排布式;
(2)写出Cu基态原子的电子排布式,找出有多少种能级,每个能级就是能量不同的原子轨道;
(3)观察题目给出的结构式分析作用力,虚线一般为氢键;
(4)碳原子采取sp2杂化的物质的结构为平面型;采取sp3杂化的物质的结构为四面体;采取sp杂化的物质的结构为直线型;
(5)根据均摊法求算晶胞中微粒个数:顶点占1/8,面占1/2,棱占1/4;
(6)分子内氢键降低物质熔沸点,分子间氢键增大物质熔沸点。
(1)因为Ni(CO)4常温时为液态,易溶于CCl4,所以固态Ni(CO)4属于分子晶
体,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2,价电子电子排布式为3d84s2;答案:分子;3d84s2;
(2)Cu基态原子的电子排布式1s22s22p63s23p63d104s1,1s、2s、2p、3s、3p、3d、4s能级能量不同,故有7种能量不同的原子轨道;答案:7;
(3)由结构式知该配合物含氢键、配位键、共价键;答案:ACE;
(4)碳原子采取sp2杂化的物质的结构为平面型;采取sp3杂化的物质的结构为四面体;采取sp杂化的物质的结构为直线型,则采取sp2杂化的有①③④,HCHO中C原子为sp2杂化,且C原子无孤电子对,则分子的立体结构为平面三角形;答案:①③④;平面三角;
(5)根据晶胞中微粒个数求算方法:顶点占1/8,面占1/2,棱占1/4,则镧(La)和镍(Ni)个数分别为8x1/8=1、8x1/2+1=5,该晶体的化学式为LaNi5;答案:LaNi5;
(6)由于邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛能够形成分子间氢键,分子内氢键降低物质熔沸点,分子间氢键增大物质熔沸点,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低;答案:小于。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
T | M层上的电子数是其原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下,单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 元素的最高正化合价是+7 |
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。