题目内容
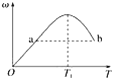
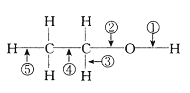
【题目】气体A的产量可以用来衡量一个国家石油化工发展水平。下图是由A为原料生产B的转化关系图,B是一种有香味的液体。

(1)将A通入溴水中,观察到的实验现象是__________,A分子中的官能团是______。
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_____________________。
(3)写出乙醇的一种用途____________________________________。
【答案】溴水褪色(或溶液褪色,合理答案均可得分) 碳碳双键(或![]() ) CH3COOH+CH3CH2OH
) CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 燃料(或化工原料等,合理答案均可得分)
CH3COOCH2CH3+H2O 燃料(或化工原料等,合理答案均可得分)
【解析】
气体A的产量可以用来衡量一个国家石油化工发展水平,则A为CH2=CH2,乙酸和乙醇在浓硫酸催化作用和加热的条件下发生酯化反应生成乙酸乙酯,则B为CH3COOCH2CH3。
(1)A为CH2=CH2,官能团为碳碳双键(或![]() ),能与溴发生加成反应而使溴水褪色,故答案为:溴水褪色(或溶液褪色,合理答案均可得分);碳碳双键(或
),能与溴发生加成反应而使溴水褪色,故答案为:溴水褪色(或溶液褪色,合理答案均可得分);碳碳双键(或![]() );
);
(2)CH3CH2OH与CH3COOH在浓硫酸催化作用和加热的条件下反应生成乙酸乙酯和水,方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)乙醇的用途很多,比如作燃料,化工原料等,故答案为:燃料(或化工原料等,合理答案均可得分)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |
【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。