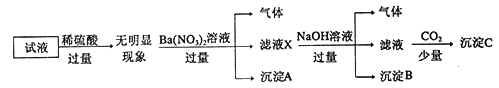
题目内容
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
A. 平衡常数约为0.25
B. B的转化率为50%
C. A的平均反应速率为0.25 mol/( L·min)
D. 若反应前后压强之比为4:3则表明该反应达到平衡状态
【答案】D
【解析】
在一定条件下,将3mol A和1mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,生成1.0molD,并测得C的浓度为0.25mol/L,C物质的量为0.25mol/L×2L=0.5mol,利用三段式列式计算。
在一定条件下,将3mol A和1mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)xC(g)+2D(g)。2min末该反应达到平衡,生成1.0molD,并测得C的浓度为0.25mol/L.C物质的量为0.25mol/L×2L=0.5mol。
2A(g)+B(g)xC(g)+2D(g)
起始量(mol) 31 0 0
变化量(mol) 1 0.5 0.5x 1
平衡量(mol) 2 0.5 0.5x 1
0.5x=0.5mol,x=1。
A.平衡常数K=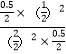 =0.25,故A正确;
=0.25,故A正确;
B.B的转化率=![]() ×100%=50%,故B正确;
×100%=50%,故B正确;
C.A的平均反应速率=![]() =0.25 mol/( Lmin),故C正确;
=0.25 mol/( Lmin),故C正确;
D.气体压强之比等于气体物质的量之比,反应前后压强之比=4∶(2+0.5+0.5+1)=1∶1,故D错误;
答案选D。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 将铜粉加入到1.0 mol·L-1 Fe2(SO4)3溶液中 | 铜粉溶解,溶液变蓝 | 金属铁比铜活泼 |
C | 将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合,达到平衡后再滴加4滴1 mol·L-1的KCl溶液 | 溶液红色加深 | 增大反应物浓度,平衡正向移动 |
D | 向10 mL 0.1 mol·L-1 AgNO3溶液中滴加4滴0.1 mol·L-1 NaCl溶液,然后再滴加4滴0.1 mol·L-1 Na2S溶液 | 先有白色沉淀生成,后有黑色沉淀生成 | 相同温度下,Ag2S的溶度积比AgCl的小 |
A. A B. B C. C D. D
【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |