题目内容
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且产生等量H2反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
【答案】A
【解析】
A.等体积pH=2的HX和HY两种酸分别与足量的铁反应,HX放出的氢气多且产生等量H2反应速率快,说明HX的浓度大,故HX的酸性比HY弱,故A正确;
B.实验操作错误,应该向2 mL 0.1 mol/L Na2S溶液中足量0.1 mol/L ZnSO4溶液,使得硫化钠反应完全;再滴入0.1 mol/L CuSO4,观察沉淀颜色的变化,确定Ksp的大小,故B错误;
C.实验设计错误,此离子反应为Fe3++3SCN-![]() Fe(SCN)3,KCl固体对平衡无影响,故C错误;
Fe(SCN)3,KCl固体对平衡无影响,故C错误;
D.实验操作错误,必须测定等浓度NaA溶液和NaB溶液的pH,否则无可比性,故D错误;
正确答案:A。

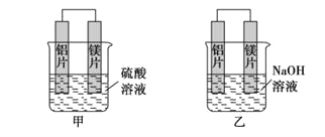
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
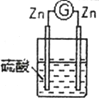
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
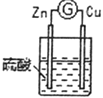
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。