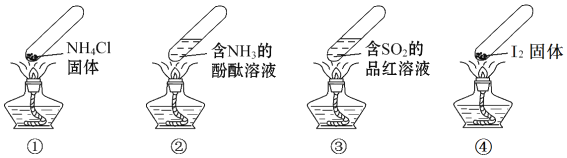
题目内容
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验![]() 夹持装置和A中加热装置已略,气密性已检验
夹持装置和A中加热装置已略,气密性已检验![]()
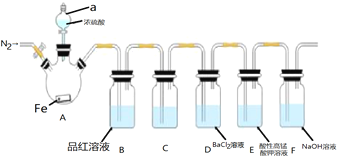
实验开始前,先打开弹簧夹通一段时间N2,关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生。已知A中白雾是硫酸与水形成的酸雾。请回答下列问题:
(1)仪器a的名称是___;
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式:___;
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是___;
A.水 B.NaOH溶液 C.饱和Na2SO3溶液 D.饱和NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是___;
(5)可以证明H2SO3是弱酸的实验装置是___;
(6)E中的现象是___,该现象表明SO2具有___性;
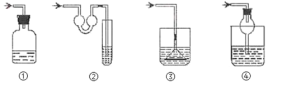
(7)装置F的作用是吸收尾气,写出该装置中反应的化学方程式___,以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___。
【答案】分液漏斗 Fe+2H2SO4(浓)![]() FeSO4+SO2↑+2H2O D 除去装置中的空气 D 高锰酸钾溶液褪色 还原性 2NaOH+SO2=Na2SO3+H2O ②④
FeSO4+SO2↑+2H2O D 除去装置中的空气 D 高锰酸钾溶液褪色 还原性 2NaOH+SO2=Na2SO3+H2O ②④
【解析】
A装置为铁和浓硫酸的反应装置,B装置为检验二氧化硫的装置,二氧化硫具有漂白性,能使品红溶液褪色,C装置为除去二氧化硫中的酸雾,防止对D装置中的现象产生干扰,D装置中装的氯化钡与二氧化硫不反应,E装置中高锰酸钾具有强氧化性,而二氧化硫具有还原性,二氧化硫能还原高锰酸钾使其褪色,F装置为尾气吸收装置,吸收二氧化硫,防止其污染空气。
(1)仪器a是分液漏斗,故答案为:分液漏斗;
(2)加入KSCN溶液未出现血红色,说明生成的不是硫酸铁,而是硫酸亚铁,则反应的化学方程式为Fe+2H2SO4(浓) ![]() FeSO4+SO2↑+2H2O,故答案为:Fe+2H2SO4(浓)
FeSO4+SO2↑+2H2O,故答案为:Fe+2H2SO4(浓) ![]() FeSO4+SO2↑+2H2O;
FeSO4+SO2↑+2H2O;
(3)硫酸为强酸,二氧化硫溶于水生成亚硫酸为弱酸,则C装置中的试剂应为能溶解硫酸,或能与硫酸反应,而不溶解二氧化硫,也不与二氧化硫反应的试剂;
A.水能与二氧化硫反应而消耗二氧化硫,故A错误;
B.NaOH溶液能与二氧化硫反应而消耗二氧化硫,故B错误;
C.饱和Na2SO3溶液能与二氧化硫反应而消耗二氧化硫,故C错误;
D.二氧化硫几乎不溶于饱和NaHSO3溶液,而硫酸能与亚硫酸氢钠发生反应生成硫酸钠、二氧化硫和水,则能用饱和NaHSO3溶液除去二氧化硫中的硫酸蒸汽,故D正确;
综上所述,故答案为:D;
(4)因为二氧化硫具有还原性,而空气中的氧气具有氧化性,对实验会造成干扰,则实验开始前,先通一段时间N2,除去装置中的空气,故答案为:除去装置中的空气;
(5)亚硫酸为弱酸,所以与氯化钡溶液不反应,则若D装置中无现象,可以证明亚硫酸为弱酸,故答案为:D;
(6)由分析知,D中强氧化性的高锰酸钾能与具有还原性的二氧化硫发生氧化还原反应而褪色,故答案为:高锰酸钾溶液褪色;还原性;
(7)因为二氧化硫是空气污染气体之一,则需要用氢氧化钠进行尾气吸收,反应的方程式为2NaOH+SO2=Na2SO3+H2O;
①装置气体进入装置后会使压强增大,不安全,故①错误;
②装置中的双耳管在发生倒吸时能承接液体,能有效防止倒吸,故②正确;
③装置的漏斗应放在与液面相切的位置,故③错误;
④装置中的干燥管在发生倒吸时能承接液体,能有效防止倒吸,故④正确;
综上所述,答案为:2NaOH+SO2=Na2SO3+H2O;②、④。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且产生等量H2反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
【题目】科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
c(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
①前10分钟内的平均速率v(NO)=___________________mol·L-1·min-1
②下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内气体的密度不变时,说明反应已达平衡
D.若该反应的平衡常数K值变大,在平衡移动过程中正反应速率先增大后减小
(2)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。
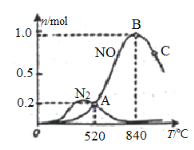
已知:反应I 4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0
4NO(g) +6H2O(g) △H<0
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g) △H<0
2N2(g) +6H2O(g) △H<0
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②反应I的活化能Ea(正)________ Ea(逆) (填“小于”“等于”或“大于”)。
③520℃时,4NH3(g)+5O2![]() 4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(3)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为________________________________________。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是________________________。