题目内容
【题目】下列各实验中需用浓盐酸而不宜用稀盐酸,请写出反应的化学方程式并阐明理由。
(1)配制SnCl2溶液时,将SnCl2(s)溶于浓盐酸后再加水稀释______。
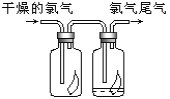
(2)加热MnO2与浓盐酸的混合物制取氯气______。
(3)需用浓盐酸与浓硝酸混合配制王水才能溶解金(生成HAuCl4)______。
【答案】Sn2++4Cl-=SnCl42-,浓盐酸作用是形成SnCl42-,可以防止Sn(OH)Cl的形成,抑制SnCl2水解 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,浓盐酸有利于提高二氧化锰的氧化性,同时提高HCl的还原性,使反应正向进行 有利于增强Au的还原性,并且提高硝酸的氧化性,有利于反应正向进行
MnCl2+Cl2↑+2H2O,浓盐酸有利于提高二氧化锰的氧化性,同时提高HCl的还原性,使反应正向进行 有利于增强Au的还原性,并且提高硝酸的氧化性,有利于反应正向进行
【解析】
(1)将SnCl2(s)溶于浓盐酸后再加水稀释,抑制水解;
(2)稀盐酸和二氧化锰不能反应生成氯气;
(3)王水的氧化性大于硝酸的氧化性;浓盐酸能提高金的还原性和浓硝酸的氧化性。
(1) SnCl2是强酸弱碱盐,在溶液中Sn2+会发生水解反应使溶液变浑浊,由于该盐水解会产生盐酸,所以配制SnCl2溶液时,将SnCl2(s)溶于浓盐酸后再加水稀释,Sn2++4Cl-=SnCl42-,浓盐酸作用是形成SnCl42-,可以防止Sn(OH)Cl的形成,抑制SnCl2水解;
(2)浓盐酸和二氧化锰反应:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,盐酸浓度越大,还原性就越强,越溶液与二氧化锰发生反应,使反应正向进行,因而可产生更多的氯气;
MnCl2+Cl2↑+2H2O,盐酸浓度越大,还原性就越强,越溶液与二氧化锰发生反应,使反应正向进行,因而可产生更多的氯气;
(3)王水的氧化性大于硝酸的氧化性,则用浓HCl溶液配制王水才能溶解金单质,反应方程式为:Au+HNO3+4HCl=HAuCl4+NO↑+2H2O,在反应中浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性,有利于反应正向进行。

 阅读快车系列答案
阅读快车系列答案【题目】实验室由间苯二酚合成2-硝基-1,3-苯二酚的原理如下:
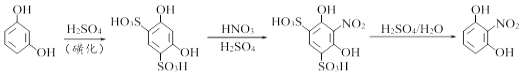
已知:
物质 | 间苯二酚 | 2-硝基-1,3-苯二酚 |
熔点 | 109~112℃ | 84.85℃ |
沸点 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相对分子质量 | 110 | 155 |
实验药品:间苯二酚、浓硫酸(98%)、混合酸(由浓硝酸和浓硫酸按2:3的体积比混合而成)、尿素等。
实验步骤:
Ⅰ.称取2.7g间苯二酚粉末,放入100mL锥形瓶中,再加入13mL浓硫酸,同时充分搅拌,反应放热,立即生成白色磺化物。
Ⅱ.当反应物冷却后,用滴管滴加预先用冰水浴冷却好的混合酸,同时进行搅拌,并使反应温度不超过30℃.将生成的黄色粘稠状液体在室温下放置15min,再用7.5mL带有碎冰的冷水稀释,保持温度在50℃以下,得到红褐色的稠状液体。
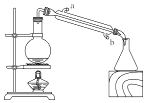
Ⅲ.将反应液转移至250mL烧瓶中(如右下图所示,夹持和加热装置均已略去),再加入0.1g尿素,进行蒸馏,蒸馏液通过抽滤,洗涤干燥后,可得到橘红色片状晶体粗品。
试回答下列问题:
(1)进行产物蒸馏时,冷却水应从______(填“a”或“b”)口进入。
(2)实验过程中,温度控制在较低温度下进行的原因可能是:______。
(3)实验过程中配制混酸的正确操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反应而被除去。其中反应之一的化学方程式为:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(标准状况下)时,则转移的电子数为______。
(5)对粗品进行(方法)可提高产品纯度。若干燥后称量所得产品的质量为 2.1g,则其产率为______(保留两位小数)。