题目内容
【题目】已知钠、氯及其化合物间有如下转化关系,
请按要求填空:
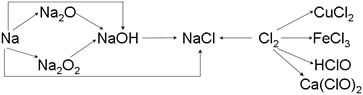
(1)实验室中金属钠通常保存在_______中,一小块金属钠投入水中反应的化学方程式是________________。
(2)Na2O2常用于呼吸面具中,有关反应的化学方程式为_____________________________,_________________________________。
(3)新制的氯水滴入紫色石蕊试液中,观察到的现象是___________________________。
请写出氯气与水反应的化学方程式_______________________________。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为_____________________________________。
【答案】 煤油 2Na+ 2H2O=2NaOH+H2↑ 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2 Cl2+ H2O =HCl + HClO 先变红后褪色 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】试题分析:(1) 金属钠极易被氧气氧化、钠易与水反应生成也氰化钠和氢气,钠的密度大于煤油;(2)过氧化钠与二氧化碳、水反应放出氧气;(3)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性;(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水。
解析:钠在空气中易被氧气氧化,钠易与水反应,金属钠的密度大于煤油,所以应该保存在煤油中。钠和水反应生成氢氧化和氢气,反应的方程式是2Na+ 2H2O=2NaOH+H2↑ 。
(2)过氧化钠是淡黄色固体,过氧化钠与二氧化碳、水反应放出氧气,反应的方程式是2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2。
(3)氯气与水反应生成盐酸和次氯酸,反应方程式为Cl2+ H2O =HCl + HClO;新制的氯水中含有盐酸和次氯酸,盐酸能使石蕊变红,次氯酸具有漂白性能使石蕊褪色,新制的氯水滴入紫色石蕊试液中的现象是先变红后褪色;
(4)工业上用氯气和石灰乳反应生成氯化钙和次氯酸钙,化学方程式为。2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O

【题目】元素周期表是一座开放的“元素大厦”,元素大厦尚未充满。若发现119号元素,请您在元素大厦中安排好它的“房间”
A. 第八周期第ⅠA族B. 第七周期第0族
C. 第七周期第ⅦA族D. 第六周期ⅡA族
【题目】化学反应原理在科研和生产中有广泛应用,根据题意回答下列问题:
I工业上制备Na2S的反应原理如下
①Na2SO4(s)===Na2S(s)+2O2(g) △H1=+1011.0kJ·mol-1
②C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)===2CO(g) △H3=-221.0kJ·mol-1
④Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) △H4
(1)△H4=___________ kJ·mol-1。
(2)反应④能自发进行的条件是___________。
(3)工业上制备Na2S不用反应①,而用反应④的理由是_____________________________。
Ⅱ.在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生反应:2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
时间(s) | 0 | 10 | 20 | 30 | 40 | …… |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | …… |
(1)计算此温度下该反应的K=______________________。
(2)达到平衡时,下列措施能提高NO转化率的是___________(填序号)。
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
Ⅲ.工业上常用臭氧处理含NO2-的废水。
(1)O3氧化NO2-可产生NO3-和O2,反应中每生成1mol的O2转移___________mol电子。
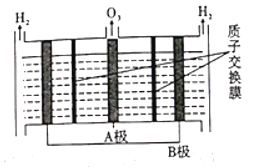
(2)O3可由电解稀硝酸制得,原理如图。图中阴极为___________(填“A”或“B”),阳极(惰性电极)的电极反应式为____________________________________________。