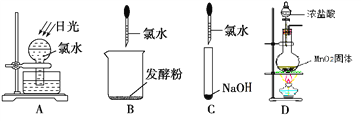
题目内容
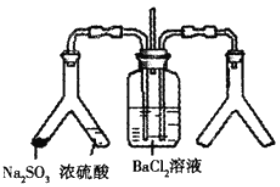
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
【答案】D
【解析】A、由装置图中物质转化关系可知,左边由 NaHSO3得到电子转化为Na2S2O4,右边由SO2失去电子转化为H2SO4,所以a电极接电源的负极,b电极接电源的正极,故A错误;B、a电极的反应式为2HSO3-+2e-+2H+= S2O42-+2H2O,b电极的反应式为SO2+2H2O-2e-=SO42-+4H+,所以装置中离子交换膜为阳离子交换膜,则B错误;C、由电极反应式可知,每转移1mole-消耗SO2的0.5mol,但没有给气体的温度和压强,所以SO2气体的体积无法计算,故C错误;D、a电极的电极反应式为2HSO3-+2e-+2H+= S2O42-+2H2O,所以D正确。本题正确答案为D。

练习册系列答案
相关题目
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()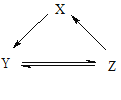
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D