题目内容
【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
【答案】AD
【解析】
A.反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),在2L容器内进行,计算KI
2CO(g)+2H2(g),在2L容器内进行,计算KI
T1n(开始)mol 0 0.8 0.8 0.8
n(变化)mol 0.1 0.1 0.2 0.2
n(平衡)mol 0.1 0.9 0.6 0.6
化学平衡常数K1= =0.36,
=0.36,
反应 CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),在2L容器内进行,计算KII
2CO(g)+2H2(g),在2L容器内进行,计算KII
T2n(开始)mol 1.0 2.0 0 0
n(变化)mol 0.5 0.5 1.0 1.0
n(平衡)mol 0.5 1.5 1.0 1.0
化学平衡常数KII= =0.33,K1>K2,由于该反应的正反应为吸热反应,根据平衡移动原理,升高温度,平衡向吸热的正反应方向移动,因此温度T1>T2,A正确;
=0.33,K1>K2,由于该反应的正反应为吸热反应,根据平衡移动原理,升高温度,平衡向吸热的正反应方向移动,因此温度T1>T2,A正确;
B.对于容器Ⅱ,Qc=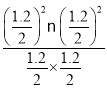 =0.36=K1,说明反应处于平衡状态,所以v(正)=v(逆),B错误;
=0.36=K1,说明反应处于平衡状态,所以v(正)=v(逆),B错误;
C.对于容器I,平衡时总物质的量n(总)=0.1mol+0.9mol+0.6mol+0.6mol=2.2mol;对于容器III,平衡时总物质的量n(总)=0.5mol+1.5mol+1.0mol+1.0mol=4.0mol,容器内气体的物质的量的比n(I):n(III)=2.2:4.0=11∶20,尽管反应容器的容积不变,但由于反应I、III反应温度不同,所以不能根据物质的量的比判断容器内气体的压强之比,C错误;
D.根据选项A分析可知容器III中CO2的转化率为(0.5÷1.0)×100%=50%;对于容器IV,反应温度与III相同,由于气体的物质的量减小,导致容器内气体压强减小,根据平衡移动原理,减小压强,平衡向气体体积扩大的正反应方向移动,使反应物CO2的转化率增大,因此容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小,D正确;
故合理选项是AD。

【题目】化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3+ + 3HCO3-= Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
A. A B. B C. C D. D