题目内容
【题目】已知室温下溶度积常数:Ksp[Pb(OH)2]=2×10-15,Ksp[Fe(OH)2]=8×10-15。当溶液中金属离子浓度小于10-5molL-1视为沉淀完全。向20mL含0.10molL-1Ph2+和0.10molL-1Fe2+的混合溶液中滴加010amolL-1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示,则下列说法正确的是( )
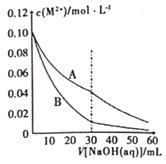
A. 曲线A表示![]() 的曲线
的曲线
B. 当溶液![]() 时,
时,![]() 开始沉淀,
开始沉淀,![]() 沉淀完全
沉淀完全
C. 滴入NaOH溶液体积大于30mL时,溶液中![]()
D. 室温下,滴加NaOH溶液过程中,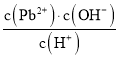 比值不断增大
比值不断增大
【答案】C
【解析】
A、Pb(OH)2的Ksp小于Fe(OH)2的Ksp;
B、当溶液pH=8时,c(OH-)=10-6mol/L,结合Ksp计算;
C、滴入NaOH溶液体积大于30mL时,溶液中c(Fe2+):c(Pb2+)=![]() ;
;
D、![]() =
=![]() 。
。
A项、Pb(OH)2的Ksp小于Fe(OH)2的Ksp,则等pH时,Fe2+浓度较大,则曲线A表示c(Fe2+)的曲线,故A错误;
B项、当溶液pH=8时,c(OH-)=10-6mol/L,此时(Fe2+)×c2(OH-)=10-12×0.1=10-13>Ksp[Fe(OH)2],Fe2+没有生成沉淀,故B错误;
C项、滴入NaOH溶液体积大于30mL时,曲线发生变化,溶液中c(Fe2+):c(Pb2+)=![]() =4:1,故C正确;
=4:1,故C正确;
D项、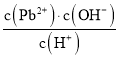 =
=![]() ,
,![]() 为定值,
为定值,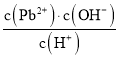 不发生变化,故D错误。
不发生变化,故D错误。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小