题目内容
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
【答案】B
【解析】
本题考查溶解度、物质的量浓度的计算,运用溶解度、物质的量浓度的计算公式分析。
t℃时,A的溶解度是Sg·100g-1,A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,则将mg无水A加入ng水中形成的溶液一定为饱和溶液,即t℃时A的溶解度为S=![]() g,A项、C项错误;该饱和溶液的质量分数为w=
g,A项、C项错误;该饱和溶液的质量分数为w=![]() ×100%=
×100%=![]() ×100%;则:c=
×100%;则:c=![]() =
=![]() =
=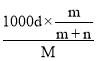 =
=![]() ,或c=
,或c=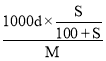 =
=![]() ,D项错误、B项正确;
,D项错误、B项正确;
答案选B。

 步步高达标卷系列答案
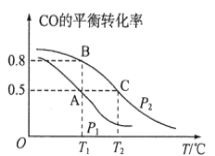
步步高达标卷系列答案【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_____________。
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.410-7 | 1.310-7 |
Ka2 | 4.710-11 | 7.110-15 |
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______;
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为________ 溶液(填化学式)。
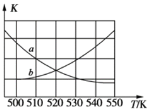
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为_____(填“a”或“b”),其判断依据是__________。
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为_____________。
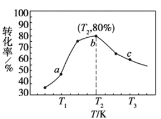
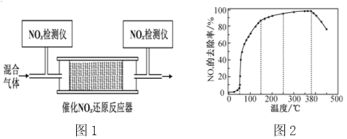
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为____mol(结果保留三位有效数字)。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是____。