题目内容
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol/L的四种溶液:①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH从大到小排列顺序为__________(填序号)。
(2)苯乙烯是工业上合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:
![]() 。
。
①已知乙苯(g)、苯乙烯(g)的燃烧热分别为akJ/mol,bkJ/mol,则氢气的燃烧热为___kJ/mol(用含有Q、a、b的表达式表示,其中Q、a、b均大于0)。
②在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如下图所示。

Ⅰ.加入水蒸气稀释剂能提高乙苯转化率的原因是__________
Ⅱ.用平衡分压代替平衡浓度计算平衡常数(Kp),其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________.
Ⅲ.改变下列条件,能使乙苯的反应速率和转化率一定增大的是_______ (填字母)。
A.恒容时加入稀释剂水蒸气
B.压强不变下,温度升至1500K
C.在容积和温度不变下充入Ar
D.选用催化效果更好的催化剂
(3)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
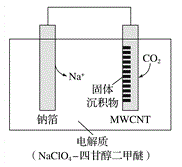
①放电时,正极的电极反应式为___________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol 电子时,两极的质量差为______g。(假设放电前两电极质量相等)
【答案】 ④>②>①>③ Q+a-b 体系总压强不变时,充人水蒸气,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大 2p/19 B 3CO2+4Na++4e-=2Na2CO3+C 15.8
【解析】试题分析:(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强; CH3COONa、 Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子;(2)根据盖斯定律计算氢气的燃烧热;②Ⅰ.通入水蒸气相当于减压,平衡正向移动;Ⅱ.利用“三段式”计算Kp;Ⅲ.根据影响反应速率和影响平衡移动的因素分析;(3)①放电时,正极得电子发生还原反应;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC ;
解析:(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强; CH3COONa、 Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子,所以同浓度的①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH从大到小排列顺序为④>②>①>③;(2)
①![]()
② C8H10(g)+ ![]() O2(g)
O2(g) ![]() 8CO2(g)+5H2O(l)
8CO2(g)+5H2O(l) ![]() - akJ/mol
- akJ/mol
③C8H8(g)+10 O2(g) ![]() 8CO2(g)+4H2O(l)
8CO2(g)+4H2O(l) ![]() - bkJ/mol,根据盖斯定律②-①-③,得氢气的燃烧热为(Q+a-b)kJ/mol;②Ⅰ.通入水蒸气相当于减压,平衡正向移动,所以加入水蒸气稀释剂能提高乙苯转化率;水与乙苯的比为8,压强为2P,900K时,乙苯的转化率为50%,
- bkJ/mol,根据盖斯定律②-①-③,得氢气的燃烧热为(Q+a-b)kJ/mol;②Ⅰ.通入水蒸气相当于减压,平衡正向移动,所以加入水蒸气稀释剂能提高乙苯转化率;水与乙苯的比为8,压强为2P,900K时,乙苯的转化率为50%,
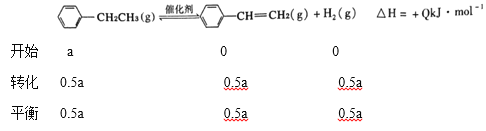
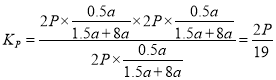 ;Ⅲ A.恒容时加入稀释剂水蒸气,体积增大,反应物浓度减小,速率速率降低,故A错误; B.正反应吸热,温度升至1500K ,速率加快,平衡正向移动,故B正确; C.在容积和温度不变下充入Ar,反应物浓度不变,所以速率不变,平衡不移动,故C错误; D.选用催化效果更好的催化剂,平衡不移动,故D错误。(3)①放电时,正极CO2得电子发生还原反应,电极反应式是3CO2+4Na++4e-=2Na2CO3+C;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC,所以两极的质量差为
;Ⅲ A.恒容时加入稀释剂水蒸气,体积增大,反应物浓度减小,速率速率降低,故A错误; B.正反应吸热,温度升至1500K ,速率加快,平衡正向移动,故B正确; C.在容积和温度不变下充入Ar,反应物浓度不变,所以速率不变,平衡不移动,故C错误; D.选用催化效果更好的催化剂,平衡不移动,故D错误。(3)①放电时,正极CO2得电子发生还原反应,电极反应式是3CO2+4Na++4e-=2Na2CO3+C;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC,所以两极的质量差为![]() 15.8g。
15.8g。