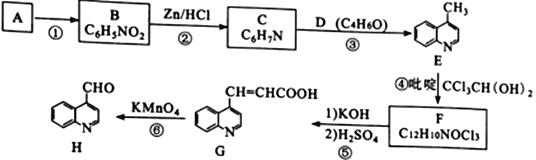
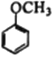
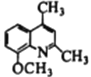
题目内容
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
【答案】B
【解析】
A.反应方程式可知,Al、O的化合价反应前后没有变化,N的化合价由“0”价变为“-3”价,而C的化合价由“0”价变为“+2”价,因此N2是氧化剂,Al2O3既不是氧化剂又不是还原剂,故A错误;
B.N的化合价由“0”价变为“-3”价,故每生成1molAlN需转移3mol电子,故B正确;
C.氮化铝中Al的化合价为“+3”价,根据化合物中各元素的正负化合价的代数和为零计算,氮元素的化合价是“-3”价,故C错误;
D.在反应过程中C由“0”价变为+2价,所以CO是氧化产物,故D错误;
所以本题答案为B。

练习册系列答案
相关题目