题目内容
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:

① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
【答案】2:1 ![]() S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol 2.5×1024 BD HCl > C2F4的产率高,副产物C3F6的含量几乎为0
S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol 2.5×1024 BD HCl > C2F4的产率高,副产物C3F6的含量几乎为0 ![]()
【解析】
⑴2F2+2NaOH═2NaF+H2O+OF2,该反应中F的化合价从0价变为-1价,O元素的化合价从-2价变为+2价,氧化剂为F2,还原剂为NaOH,氧化剂与还原剂的物质的量之比为2:1,二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为![]() 。
。
⑵反应热ΔH=反应物总键能![]() 生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol。
生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol。
⑶Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,该反应的平衡常数 。
。
⑷①A选项,制备四氟化烯反应前后都为气体,在恒容的条件下,混合气体密度始终保持改变,故A错误;B选项,制备四氟化烯的反应,反应前后物质的量在变化,混合气体的平均相对分子质量![]() ,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确。
,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确。
②根据两个方程式得出可知氯化氢的物质的量一直在增加,且增加量最大,因此A为氯化氢。
③根据图示可知,随着温度的升高CHClF2物质的量在减少,所以正反应为吸热反应,即2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H > 0。
C2F4(g)+2HCl(g)的△H > 0。
④通过图示可知,在900C以上,副产物C3F6的含量几乎为0,工业上常在900C以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0。
⑸盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,则生成的
c(HF) = 0.5bmol/L,溶液呈中性,溶液显中性,故c(H+)= c(OH-)=1×10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(F-) + c(Cl-)=c(Na+) =0.5amol/L,所以c(F-) = (0.5a
-0.5b) mol/L,HF的电离常数![]() 。
。
⑴2F2+2NaOH═2NaF+H2O+OF2,该反应中F的化合价从0价变为-1价,O元素的化合价从-2价变为+2价,氧化剂为F2,还原剂为NaOH,氧化剂与还原剂的物质的量之比为2:1,二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为![]() ,故答案为:2:1;
,故答案为:2:1;![]() 。
。
⑵反应热ΔH=反应物总键能![]() 生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol,故答案为:S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol。
生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol,故答案为:S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol。
⑶Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,该反应的平衡常数 ;故答案为:2.5×1024。
;故答案为:2.5×1024。
⑷①A选项,制备四氟化烯反应前后都为气体,在恒容的条件下,混合气体密度始终保持改变,故A错误;B选项,制备四氟化烯的反应,反应前后物质的量在变化,混合气体的平均相对分子质量![]() ,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确;综上所述,答案为:BD。
,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确;综上所述,答案为:BD。
②根据两个方程式得出可知氯化氢的物质的量一直在增加,且增加量最大,因此A为氯化氢,故答案为:HCl。
③根据图示可知,随着温度的升高CHClF2物质的量在减少,所以正反应为吸热反应,即2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H > 0,故答案为:> 。
C2F4(g)+2HCl(g)的△H > 0,故答案为:> 。
④通过图示可知,在900C以上,副产物C3F6的含量几乎为0,工业上常在900C以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0,故答案为:C2F4的产率高,副产物C3F6的含量几乎为0。
⑸盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,则生成的
c(HF) = 0.5bmol/L,溶液呈中性,溶液显中性,故c(H+)= c(OH-)=1×10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(F-) + c(Cl-)=c(Na+) =0.5amol/L,所以c(F-) = (0.5a
-0.5b) mol/L,HF的电离常数![]() ,故答案为:
,故答案为:![]() 。
。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为________ mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
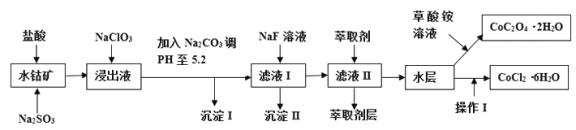
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等.
②沉淀I中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为___________。
(2)NaClO3在浸出液中发生的离子反应方程式为_________________。
(3)加入Na2CO3调PH至5.2,目的是__________________________;萃取剂层含锰元素,则沉淀II的主要成分为_____________。
(4)操作I包括:将水层加入浓盐酸调整PH为2~3,___________、____________、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是____________________(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为__。
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]


