题目内容
【题目】环境问题已成为全球普遍的热门话题。
(1)利用甲烷催化还原氨氧化物。已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H1=-867kJmol-1,CH4(g) +4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2=-574kJmol-1,则CH4将NO还原为N2的热化学方程式为___。
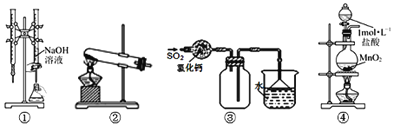
(2)用NH3催化还原NOX也可以消除氮氧化物的污染.如图采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) +NO2(g) +2NH3(g) 2N2(g)+3H2O(g)。
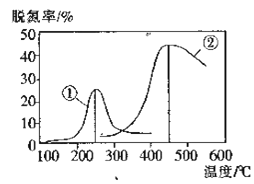
①该反应的△S___0,△H___0(填“>”、“=”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB )代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp=______。
③以下说法正确的是___(填标号)。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)催化反硝化法和电化学沉解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2能NO3-还原为N2,一段时间后,溶液的碱性明显增强,则反应离子方程式为____。
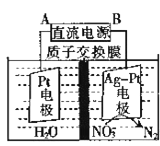
②电化学降解NO3-的原理如图所示。电源正极为______(填A或B),阴极反应式为______。
【答案】CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =- 1160kJmol-1 > < ![]() C 3H2 + 2 NO3-
C 3H2 + 2 NO3- ![]() N2 + OH- + 4H2O A 2NO3- + 12H+ + 10e- = N2 + 6H2O
N2 + OH- + 4H2O A 2NO3- + 12H+ + 10e- = N2 + 6H2O
【解析】
⑴根据盖斯定律,第1个方程乘以2再减去第2个方程得到CH4将NO还原为N2的热化学方程式为CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =- 1160kJmol-1。
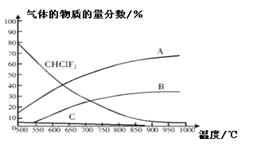
⑵①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S > 0,根据①、②图象可知,达到平衡后升高温度,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H < 0。
②对于气体反应,用某组分(B)的平衡压强(pB )代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则反应NO(g) +NO2(g) +2NH3(g) 2N2(g)+3H2O(g)的![]() 。
。
③A选项,催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;B选项,该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;C选项,由图象可知,催化剂①、②分别适合于250C和450C左右脱氮,其催化活性最好,故C正确;综上所述,答案为C。
⑶①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,生成氢氧根离子,硝酸根离子被还原为氮气,结合电荷守恒配平书写离子方程式:3H2 + 2 NO3- ![]() N2 + OH- + 4H2O。
N2 + OH- + 4H2O。
②由图示知在Ag—Pt电极上NO3-发生还原反应,因此Ag—Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3- + 12H+ + 10e- = N2 + 6H2O。
⑴根据盖斯定律,第1个方程乘以2再减去第2个方程得到CH4将NO还原为N2的热化学方程式为CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =- 1160kJmol-1,故答案为:CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =- 1160kJmol-1。
⑵①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S > 0,根据①、②图象可知,达到平衡后升高温度,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H < 0,故答案为:>;<。
②对于气体反应,用某组分(B)的平衡压强(pB )代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则反应NO(g) +NO2(g) +2NH3(g) 2N2(g)+3H2O(g)的![]() ,故答案为:
,故答案为:![]() 。
。
③A选项,催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;B选项,该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;C选项,由图象可知,催化剂①、②分别适合于250C和450C左右脱氮,其催化活性最好,故C正确;综上所述,答案为C。
⑶①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,生成氢氧根离子,硝酸根离子被还原为氮气,结合电荷守恒配平书写离子方程式:3H2 + 2 NO3- ![]() N2 + OH- + 4H2O,故答案为:3H2 + 2 NO3-
N2 + OH- + 4H2O,故答案为:3H2 + 2 NO3- ![]() N2 + OH- + 4H2O。
N2 + OH- + 4H2O。
②由图示知在Ag—Pt电极上NO3-发生还原反应,因此Ag—Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3- + 12H+ + 10e- = N2 + 6H2O,故答案为:A;2NO3- + 12H+ + 10e- = N2 + 6H2O。

【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____。
(2)加入沸石的作用是_____。若加热后发现未加沸石,应采取的正确方法是______。
(3)上述装置图中,B仪器的名称是_____,D仪器的名称是_____。
(4)分液漏斗使用前必须进行的操作是_____(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____。
(7)本实验中,正丁醛的产率为_____%。