题目内容
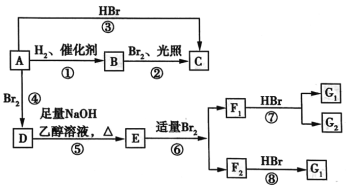
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___;
②在工业生产中B气体的大量排放被雨水吸收后形成了____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A_____;C____。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式____。
【答案】H2SO4 酸雨 N2 NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
【解析】
根据框图,非金属单质A能发生连续氧化,含氧酸D为强酸,对应的是硫和氮等元素的转化。
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A为S单质,B为SO2,C为SO3,D为H2SO4。
(2)A在常温下为气体,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3。
据此分析解答。
根据框图,非金属单质A能发生连续氧化,含氧酸D为强酸,对应的是硫和氮等元素的转化。
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A为S单质,B为SO2,C为SO3,D为H2SO4。
①由以上分析可知D是硫酸,化学式为H2SO4,故答案为:H2SO4;
②在工业生产中大量排放的SO2气体被雨水吸收后形成了酸雨而污染了环境,故答案为:酸雨;
(2)若A在常温下为气体,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3。
①由以上分析可知A为N2,C为NO2,故答案为:N2;NO2;
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。

 优生乐园系列答案
优生乐园系列答案【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(Cl—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(3)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
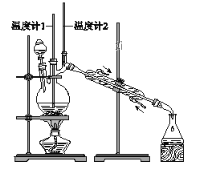
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物