题目内容
5.常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是( )| A. | 有溶质析出 | B. | 溶液中Ca2+的数目不变 | ||
| C. | 溶剂的质量减小 | D. | 溶液的pH不变 |
分析 生石灰与水反应生成氢氧化钙,此过程中饱和溶液中溶剂的质量减小,故会有溶质析出,那么钙离子的物质的量减小,由于温度不变,故此饱和溶液的溶度积不变,即氢氧根的浓度不变,据此选择即可.
解答 解:A、氧化钙溶于水,结合水生成氢氧化钙,故水的质量减少,有溶质析出,故A正确;
B、由于溶质减小,温度不变,溶解度不变,故钙离子的物质的量减小,即溶液中Ca2+的数目减少,故B错误;
C、水与氧化钙反应生成氢氧化钙,质量减小,故C正确;
D、此时温度不变,氢氧化钙的溶度积常数不变,故氢氧根浓度不变,pH不变,故D正确,
故选B.
点评 本题主要考查的是饱和溶液的概念、难溶电解质的溶解平衡等知识点,属于常考题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.常温下0.2mol/L的一元素HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度大小为:0.1mol/L>c(X)>c(Y)>c(Z),下列说法正确的是( )
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
10.在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成.对于该反应的说法一定正确的是( )
| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
17.设NA为阿伏加德常数,下列叙述正确的是( )
| A. | 1L0.1mol•L-1碳酸钠溶液中的阴离子总数为0.1NA | |
| B. | 将400mL1mol/L的HNO3溶液与7gFe粉充分反应,电子转移数为0.375NA | |
| C. | 标准状况下,14g氦气中共用电子对的数目为1.5NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8kJ/mol的转化率为30%,当放出91.8kJ热量时,生成氨分子的数目为0.6NA |
14.在一定温度下,将足量的AgCl固体分别加入①10mL蒸馏水②30mL0.1mol•L-1NaCl溶液;③5ml 0.5 mol•L-1NaCl溶液; ④10ml 0.2 mol•L-1HCl溶液中.使AgCl溶解并达到饱和,各溶液中Ag+浓度由大到小排列的正确顺序是 ( )
| A. | ④>②>③>① | B. | ①>②>③>④ | C. | ①>②>④>③ | D. | ①>③>②>④ |
11.下面是实验探究同一主族元素性质的递变规律
(1)探究碱金属从锂到铯金属性的递变规律,通常设计Na、K单质与水反应对比来说明.请描述K与水反应的现象钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生,反应的化学方程式为2K+2H2O=2KOH+H2↑,比Na跟水反应更剧烈.
(2)探究卤素从F到I的非金属性的递变规律
某学生设计了如下的实验方案,请帮助该学生整理并完成实验报告.
①实验用品
仪器:试管、胶头滴管
药品:新制的氯水、氯化钠溶液、溴化钠溶液、KI溶液、四氯化碳
②实验内容(在下表留空的格中填写相关内容)
(1)探究碱金属从锂到铯金属性的递变规律,通常设计Na、K单质与水反应对比来说明.请描述K与水反应的现象钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生,反应的化学方程式为2K+2H2O=2KOH+H2↑,比Na跟水反应更剧烈.
(2)探究卤素从F到I的非金属性的递变规律
某学生设计了如下的实验方案,请帮助该学生整理并完成实验报告.
①实验用品
仪器:试管、胶头滴管
药品:新制的氯水、氯化钠溶液、溴化钠溶液、KI溶液、四氯化碳
②实验内容(在下表留空的格中填写相关内容)
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
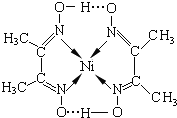 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).