题目内容
13.下列有机物系统命名正确的是( )| A. | 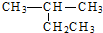 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 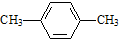 对二甲苯 对二甲苯 | D. | 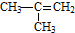 2-甲基-2-丙烯 2-甲基-2-丙烯 |
分析 A、烷烃命名时选择最长的碳链为主链;
B、用羟基所在碳原子的编号表示出羟基的位置;
C、“邻、间、对”是系统命名法;
D、要用双键两端编号较小的碳原子表示双键的位置.
解答 解:A、烷烃命名时选择最长的碳链为主链,故主链上有4个碳原子,故名称为2-甲基丁烷,故A错误;
B、醇在命名时,从离官能团近的一端开始编号,要用羟基所在碳原子的编号表示出羟基的位置,故此醇的名称为1-丁醇,故B正确;
C、“邻、间、对”是系统命名法,苯的同系物的系统命名法是从简单的侧链按顺时针或逆时针给苯环上的碳原子编号,使侧链的位次和最小,故此物质的系统命名法为:1,4-二甲基苯,故C错误;
D、烯烃命名时,从离官能团近的一端开始编号,要用双键两端编号较小的碳原子表示双键的位置,故正确的名称为:2-甲基-1-丙烯,故D错误.
故选B.
点评 本题考查了烷烃、烯烃和醇的命名,难度不大,应注意的是烯烃命名时,从离官能团近的一端开始编号,要用双键两端编号较小的碳原子表示双键的位置.

练习册系列答案
相关题目
3.碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
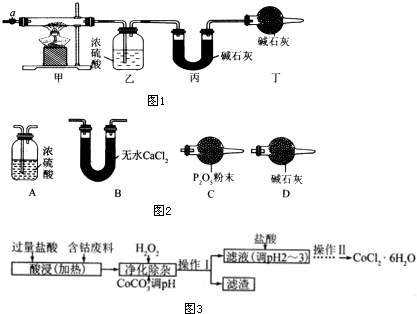
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
则该碱式碳酸钴的化学式为Co2(OH)4(CO3)2.
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
4.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
1.111号元素Rg所在周期和族是( )
| A. | 第七周期ⅠB族 | B. | 第七周期ⅡB族 | C. | 第六周期ⅠB族 | D. | 第六周期ⅡB族 |
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题:
(1)已知BA5为离子化合物,写出其电子式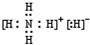 .
.
(2)B的基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为: ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)请写出元素D、E、F原子的最外层电子的成对电子数1、3、1.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |
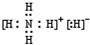 .
.(2)B的基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)请写出元素D、E、F原子的最外层电子的成对电子数1、3、1.
5.已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是( )
| A. | 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
2.下列关系正确的是( )
| A. | 沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 同物质的量的物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
3.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
 ;
;