题目内容
7.如图为实验室制取、检验和收集纯净干燥的氯气的实验装置图: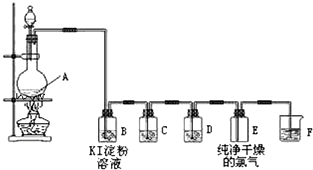
(1)装置A的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)装置B中的现象是无色溶液变成蓝色
(3)装置C中所装试剂是饱和食盐水,作用是除去除去HCl;装置D中所装试剂是浓硫酸,作用是除水蒸气.
(4)装置F是氯气的尾气处理装置,发生反应的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
分析 实验室制取、检验和收集纯净干燥的氯气,由实验装置可知,A中发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B中淀粉KI检验氯气,氯气氧化KI生成碘,则碘遇淀粉变蓝,C中饱和食盐水除去HCl,D中浓硫酸干燥氯气,E收集氯气,F中NaOH溶液吸收尾气,以此来解答.
解答 解:(1)装置A中发生二氧化锰与浓盐酸的反应,化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B中淀粉KI检验氯气,现象为无色溶液变成蓝色,故答案为:无色溶液变成蓝色;
(3)装置C中所装试剂是饱和食盐水,作用是除去HCl,D中所装试剂是浓硫酸,其作用为除水蒸气,故答案为:除去HCl;浓硫酸;除水蒸气;
(4)装置F是氯气的尾气处理装置,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查氯气的制备实验设计,为高频考点,把握物质的性质、实验装置的作用、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
5.反应2C+O2═2CO的能量变化如图所示.下列说法正确的是( )


| A. | 12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g)△H=-221 kJ | |
| C. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
18.有机物X、Y分子式不同,它们只含C、H、O元素中的两种或三种,若将X、Y不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量也不变.X、Y可能是( )
| A. | C2H2、C6H6 | B. | C2H4、C2H6O | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
15.为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-═I2+2Fe2+)
Ⅱ.继续加入2mL CCl4振荡.Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
ⅱ.写出实验操作“步骤一”中反应的离子方程式为4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓.
I.取5mL 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-═I2+2Fe2+)
Ⅱ.继续加入2mL CCl4振荡.Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
16.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S.还含有Fe2O3、SiO2 及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下:
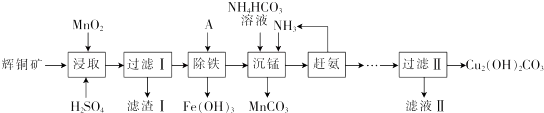
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
回答下列问题:
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.

已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |