题目内容
6.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: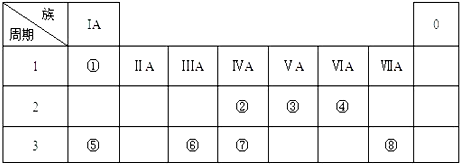
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3.
(3)③的气态氢化物的电子式
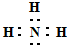 .
.(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑、Cl2+2OH-=Cl-+ClO-+H2O.
(5)单质①在单质⑧中燃烧,火焰为苍白色.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层相同时核电荷数越大半径越小;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)③的气态氢化物为氨气;
(4)Al与NaOH溶液反应生成偏铝酸钠和氢气;氯气与NaOH溶液反应生成氯化钠、次氯酸钠;
(5)单质①在单质⑧中燃烧,生成HCl.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)非金属性Cl>C>Si,则最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(3)③的气态氢化物为氨气,其电子数为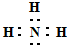 ,故答案为:
,故答案为: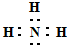 ;
;
(4)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;氯气与NaOH溶液反应生成氯化钠、次氯酸钠,离子反应为Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Cl2+2OH-=Cl-+ClO-+H2O;
(5)单质①在单质⑧中燃烧,生成HCl,火焰为苍白色,故答案为:苍白.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
16.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S.还含有Fe2O3、SiO2 及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下:
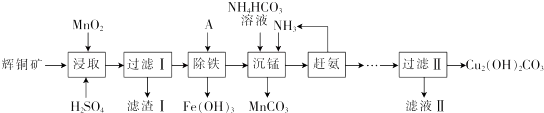
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
回答下列问题:
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.

已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Fe与过量的稀HNO3反应,转移2 NA个电子 | |
| B. | 常温常压下,22.4L的NO2和CO2合气体含有2 NA个O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA个HCO3- | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
1.A、B、C、D、E、F为六种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C是地壳中含量最高的元素;在元素周期表中,F和C是周期不同、族相邻的关系,且F和E的原子序数之和为30,它们两两形成的化合物为甲、乙、丙、丁、戊、,这五种化合物中原子个数比如下表:(用元素符号作答)
(1)写出F在周期表中的位置:第三周期VIIA族;
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子个数比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
11.密闭容器内有M、N、P、Q四种物质,一定条件下反应一段时间后,测得密闭容器内仍然是M、N、P、Q四种物质,反应前和反应一段时间后各自的物质的质量见表:
下列说法正确的是( )
| 物质 | M | N | P | Q |
| 反应前质量(g) | 15.8 | 8.4 | 31.6 | 1.6 |
| 一段时间后质量(g) | 待测 | 14 | 21.6 | 6 |
| A. | 该反应类型属置换反应 | B. | 物质P一定是化合物 | ||
| C. | 反应生成的N与Q的质量比为7:3 | D. | M肯定为该反应的催化剂 |
18.已知t℃时,盐M(不含结晶水,相对分子质量为126)的溶解度为S克.在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液.若用M•7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入M•7H2O的质量(克)为( )
| A. | 2a | B. | (2+$\frac{S}{100}$)a | C. | $\frac{200a}{100-S}$ | D. | (1+$\frac{S}{50}$)a |
15.下列关于指定粒子构成的叙述中,不正确的是( )
| A. | 37Cl与39K具有相同的中子数 | |
| B. | 第114号元素的一种核素${\;}_{114}^{298}X$与${\;}_{82}^{207}Pb$具有相同的最外层电子数 | |
| C. | O22-与S2-具有相同的质子数和电子数 | |
| D. | H3O+与OH-具有相同的质子数和电子数 |

