��Ŀ����
6���������Ϊʳ��-�����Ӽ������⻯�����ǻ���������һ����Ҫԭ�ϣ���ԭ�������⻯�����ɵ����������ط�Ӧ���ɵ���غ��ü��ỹԭ���ã�����Ҫ������ͼ��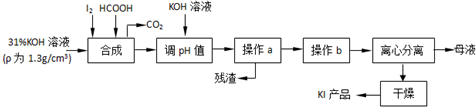
��ش��������⣺
��1���жϡ��ϳɡ������У����Ƿ�����ȫ��Ӧ�ķ�����ȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮��δ��ȫ��Ӧ��
��2������a���õ���Ҫ���������Dz��������ձ���©��������b��������Ũ������ȴ�ᾧ��
��3��д�����ϳɡ������У�HCOOH��������ӷ�Ӧ����ʽ��3HCOOH+IO3-=I-+3H2O+3CO2����
��4���ⶨ��Ʒ��KI�����ķ����ǣ�
a����ȡ3.340g��Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�
b����ȡ25.00mL��Һ����ƿ�У���������KIO3��������ϡ�����ữ��ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������0.2400mol/L��Na2S2O3��Һ�ζ���������Һ���ƽ��ֵΪ10.00mL��
��֪��I2+2S2O32-��2I-+S4O62-����ɫ����
�ٲⶨ��������������ʹ��ǰ�������Ƿ�©Һ����250mL����ƿ���ζ��ܣ�
�ڸ���Ʒ��KI����������Ϊ0.994��99.4%��������3λ��Ч���֣�
��������̫����������õ�KI��������������ƫ�������Ӱ�족����ƫ�͡���ƫ�ߡ�����
��5����ѧ��ѡ�ü�ͥ�����е��йص��ϣ���ƾơ��״ס����͡�ζ���ȣ����ü�㷽��������Ƿ��Ǽӵ�ʳ�Σ�ͨ��ʵ�������ֳ���ֻҪ��ʳ�ΰ�װ�ķ�ڴ���һ���⻯�ص�����ֽ�����ڴ���ע��ʹ�÷������ܼ�����α��������д�����ʹ��˵����ȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ��Σ�
���� �ɵ����������ط�Ӧ���ɵ���غ��ü��ỹԭ���������KI�Ͷ�����̼���壬������ҺpH���˳�ȥ���ʣ���Һ������Ũ������ȴ�ᾧ�����롢����ɵõ��⻯�أ�
��1�����õ��ۼ�����Ƿ���ȫ��Ӧ��
��2������a��Ŀ�ķ�������Һ�壬���Բ���aΪ���ˣ��ݴ�д�������ƣ�KI���ܽ�����¶ȵ�Ӱ��ϴ�Ҫ��KI��Һ�л��KI���壬����ͨ������Ũ������ȴ�ᾧ�ķ�����
��3���������֪���ỹԭ���������KI�Ͷ�����̼���壬ͬʱ����ˮ��
��4���ⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ����Ϲ�ϵʽ�����㣻������̫����Na2S2O3���ױ������е�����������
��5��������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ��
��� �⣺�ɵ����������ط�Ӧ���ɵ���غ��ü��ỹԭ���������KI�Ͷ�����̼���壬������ҺpH���˳�ȥ���ʣ���Һ������Ũ������ȴ�ᾧ�����롢����ɵõ��⻯�أ�
��1�����õ��ۼ�����Ƿ���ȫ��Ӧ����������Ϊȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮����δ��ȫ��Ӧ��
�ʴ�Ϊ��ȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮��δ��ȫ��Ӧ��
��2������a��Ŀ�ķ�������Һ�壬���Բ���aΪ���ˣ�������������Ϊ���������ձ���©����KI���ܽ�����¶ȵ�Ӱ��ϴ�Ҫ��KI��Һ�л��KI���壬����ͨ������Ũ������ȴ�ᾧ�ķ������ʲ���bӦ��������Ũ������ȴ�ᾧ��
�ʴ�Ϊ�����������ձ���©��������Ũ������ȴ�ᾧ��
��3�����ỹԭ���������KI�Ͷ�����̼���壬ͬʱ����ˮ����Ӧ�����ӷ���ʽΪ3HCOOH+IO3-=I-+3H2O+3CO2����
�ʴ�Ϊ��3HCOOH+IO3-=I-+3H2O+3CO2����
��4���ٲⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ��
�ʴ�Ϊ��250mL����ƿ���ζ��ܣ�
��KIO3��KI��Ӧ��ȫ�Ļ�ѧ����ʽΪIO3-+5I-+6H+=3I2+3H2O��
��Ӧ�Ĺ�ϵʽΪ5I-��3I2��6S2O32-��n��Na2S2O3��=0.2400mol/L��0.01L=2.4��10-3mol��
�ɹ�ϵʽ��֪n��KI��=2.4��10-3mol��$\frac{5}{6}$=2��10-3mol��
��3.340g��Ʒ�к���KI������Ϊ2��10-3mol��$\frac{250}{25}$��166g/mol=3.32g��
����Ʒ��KI����������Ϊ$\frac{3.32}{3.34}$=0.994��99.4%��
�ʴ�Ϊ��0.994��99.4%��
��������̫����Na2S2O3���ױ������е�����������������Na2S2O3��Һ�����ƫ�����Բ�õ�KI��������������ƫ��
�ʴ�Ϊ��ƫ��
��5��������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ������Ϊȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ��Σ�
��ȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ��Σ�
���� ���⿼���Ϊ�ۺϣ��漰���ʵķ��롢�ᴿ�Լ������IJⶨ��֪ʶ��Ϊ�߿��������ͣ�������ѧ���ķ�����ʵ��ͼ��������Ŀ��飬��Ŀ�Ѷ��еȣ�����ע��������غ�ĽǶ����ù�ϵʽ�����㴿�ȣ�

 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�| A�� | �ڴ˷�Ӧ����������ǿ�����ԣ�ȫ������ԭ | |
| B�� | ��Ӧ�����Һ���ټ�������������ٷ�����ѧ��Ӧ | |
| C�� | ԭ������ڷ�Ӧ����ԭ��������δ����ԭ������֮��Ϊ1��4 | |
| D�� | ԭ������ڷ�Ӧ����ԭ��������δ����ԭ������֮��Ϊ1��5 |

| A�� | 12 g C��s����һ����O2��g����Ӧ����14 g CO��g���ų�������Ϊ110.5 kJ | |
| B�� | �÷�Ӧ���Ȼ�ѧ����ʽ��2C��s��+O2��g���T2CO��g����H=-221 kJ | |
| C�� | 2 mol C��s��������O2��g����Ӧ����CO2��g�����ų�����������221 kJ | |
| D�� | �÷�Ӧ�ķ�Ӧ�ȵ���CO�����л�ѧ���γ�ʱ���ͷŵ���������O2�����л�ѧ������ʱ�����յ��������IJ� |
| A�� | C2H2��C6H6 | B�� | C2H4��C2H6O | C�� | CH2O��C3H6O2 | D�� | CH4��C2H4O2 |
I��ȡ5mL 0.1mol/L��KI��Һ���μӼ���FeCl3ϡ��Һ����֪��2Fe3++2I-�TI2+2Fe2+��
��������2mL CCl4����ȡ��ȡ����ϲ���Һ���μ�KSCN��Һ��
��1��̽���I��ʵ������Ϊ��Һ���ػ�ɫ��̽������ʵ������Ϊ��Һ�ֲ㣬�²�CCl4����Ϻ�ɫ��
��2��̽��������ͼ��ͨ������Ѫ��ɫ��Fe��SCN��3��Һ����֤��Fe3+�������Ӷ�֤����ѧ��Ӧ��һ�����ȣ�����ʵ����ȴδ����Һ��Ѫ��ɫ���Դ�ͬѧ��������������ֲ��룺
����һ��Fe3+ȫ��ת��ΪFe2+��
����������ɵ�Fe��SCN��3Ũ�ȼ�С������ɫ�������۲죮
Ϊ����֤���룬�������ϻ��������Ϣ��
��Ϣһ����������ˮ��Fe��SCN��3�������е��ܽ�ȱ���ˮ�д�Fe��SCN��3������������ˮ�г��ֵ���ɫ��ͬ��
��Ϣ����Fe3+����[Fe��CN��6]4-��Ӧ������ɫ��������K4[Fe��CN��6]����ɫ����Һ����Fe3+�������ȱ���KSCN���ߣ��������Ϣ�����������ʵ�鷽����֤���룺
����������±�ʵ�����������ͽ���
| ʵ �� �� �� | �� �� �� �� �� |
| ����һ��ȡ��ȡ����ϲ���Һ�μ�2��K4[Fe��CN��6] | ����������ɫ������ ��ڲ���һ�������� |
���������̽����������Һ�м����������ѣ���������÷ֲ� | �������Ѳ��Ѫ��ɫ�� ��ܲ���������� |
��֪����[Cu��NH3��4]SO4�ڳ������ȶ�������ˮ�л�ֽ�����NH3��
�ڲ��ֽ��������������������������pH��Χ���±���ʾ����ʼ������pH����������Ũ��Ϊ1.0mol•L-1 ���㣩��
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
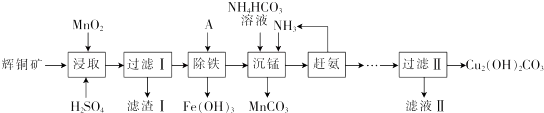
��1���ܼӿ��ȡ���ʵĴ�ʩ�з����ʯ�������¶ȣ����ʵ��������Ũ�Ȼ���裩������д2����
��2����ȡ��õ��Ľ���Һ�к���CuSO4��MnSO4��д����ȡʱ����CuSO4��MnSO4��Ӧ�Ļ�ѧ����ʽ��2MnO2+Cu2S+4H2SO4=S��+2CuSO4+2MnSO4+4H2O������I�ijɷ�Ϊ MnO2��SiO2��S��
��3�����������ķ�����ͨ��������ҺpH��ʹ Fe3+ˮ��ת��ΪFe��OH��3��������Լ�A�����ǰ�ˮ���ѧʽ����������ҺpH�ķ�ΧΪ3.2��PH��4.4��
��4�������̡�����Mn2+�������з�����Ӧ�����ӷ���ʽΪMn2++HCO3-+NH3=MnCO3��+NH4+�����ϰ���ʱ�������˵IJ�������Ϊ���ȣ�
��5���ⶨ��ʽ̼��ͭ������õζ�������ȡ6.2500g��Ʒ��100ml_С�ձ��У�����20ml������ˮ���裬�ټ���8ml.6mol•L-1 ����ʹ����ȫ�ܽ⣬��ȴ����ת����250mL����ƿ�У���ˮ���ݣ�ҡ�ȣ���ȡ25.00mL��õ���Һ����ƿ�У�����40��OO mL0.2000mol•L-1 EDTA��Һ��Ȼ�����ָʾ��������0.2000mol•L-1��Zn2+����Һ�ζ����յ㣬���ı���Һ18.00mL����֪EDTA��Cu2+��Zn2+�������ʵ�����1��1��Ӧ������Ʒ�е�Cu2��OH��2CO3��������Ϊ��78.14%��

 ��ѧ����������Ȥ��ʵ�飬���½��ܵġ���ƿ�ӡ�ʵ�����һ������250mLԲ����ƿ�����μ���2g�������ơ�100mL����ˮ��2g�����ǣ���ĩ������ʹ���ܽ⣮����4〜6��0.2%���Ǽ�����Һ������ƿ������ͼ����
��ѧ����������Ȥ��ʵ�飬���½��ܵġ���ƿ�ӡ�ʵ�����һ������250mLԲ����ƿ�����μ���2g�������ơ�100mL����ˮ��2g�����ǣ���ĩ������ʹ���ܽ⣮����4〜6��0.2%���Ǽ�����Һ������ƿ������ͼ����