题目内容
1.课本实验中出现的“草酸溶液与酸性高锰酸钾溶液反应,其反应速率逐渐加快”.经分析某粒子具有催化作用,该粒子是( )| A. | H+ | B. | SO42- | C. | MnO4- | D. | Mn2+ |
分析 一般来说,增大浓度、温度、压强、加入催化剂,增大固体表面积等,可增大反应速率.催化剂在化学反应里能改变其它物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变.“草酸溶液与酸性高锰酸钾溶液反应,其反应速率逐渐加快”,说明生成物中产生的某种离子具有催化作用,经分析某粒子具有催化作用,根据离子反应方程式分析产物中Mn2+起到催化作用,以此解答该题.
解答 解:酸性溶液KMnO4与草酸发生氧化还原反应:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,“草酸溶液与酸性高锰酸钾溶液反应,其反应速率逐渐加快”,经分析某粒子具有催化作用,逐渐加快说明是生成物中产生的某种离子具有催化作用,若是反应物微粒,反应现象为开始很快,后逐渐减慢,所以A.H+、B.SO42-、C.MnO4-三种反应物微粒不是催化微粒,产物中二氧化碳挥发,水本身反应前为溶液,只有二价锰离子加快了反应速率,起到催化作用,
故选D.
点评 本题考查化学反应速率的影响因素催化剂,题目难度不大,注意相关基础知识的积累,注意催化剂的定义:“一变二不变”指:一变指:改变其他物质的化学反应速率;二不变指:催化剂的质量和化学性质不变,该题需紧扣题干信息解答.

练习册系列答案
相关题目
16.已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2bkJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4bkJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=bkJ/mol |
6. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.CO和H2O浓度变化如图,则 0-4min的平均反应速率v(CO)=0.03mol/(L•min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min-4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)△H<0.CO和H2O浓度变化如图,则 0-4min的平均反应速率v(CO)=0.03mol/(L•min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
13.下列说法正确的是( )
| A. | 一定条件下, 水解的产物之一是 水解的产物之一是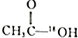 | |
| B. | 油脂的水解又称为皂化,其产物之一高级脂肪酸可用于制造肥皂 | |
| C. | 丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 | |
| D. | 蔗糖、麦芽糖分子式都为C12H22O11,均能发生银镜反应 |
11.将10克Na2O2、Na2O、Na2CO3、NaOH混合物与100克质量分数3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
| A. | 5.85 g | B. | 11.7 g | C. | 8 g | D. | 15.5 g |
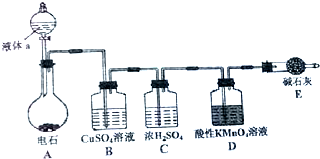 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.