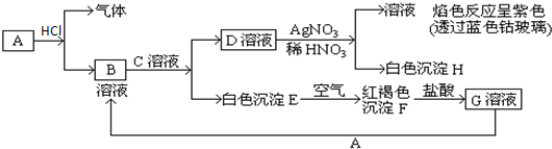
题目内容
9.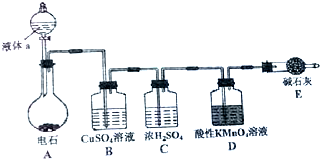 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.(1)写出实验室制取乙炔的化学方程式:CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)实验室制取乙炔时,分液漏斗中的液体a通常是饱和食盐水.
(3)CuSO4溶液的作用是吸收杂质气体硫化氢、磷化氢等.
(4)装置D中的现象是:酸性KMnO4溶液褪色.
(5)乙炔点燃之前必须进行的操作是验纯.
分析 (1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率;
(3)此反应中会产生杂质气体硫化氢、磷化氢等,会对乙炔性质实验造成干扰,据此解答;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色;
(5)可燃性的气体与氧气混合,点燃易发生爆炸.
解答 解:(1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,
故答案为:饱和食盐水;
(3)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢、磷化氢气体,以避免干扰,
故答案为:吸收杂质气体硫化氢、磷化氢等;
(4)乙炔含有碳碳三键,能与高锰酸钾溶液反应C2H2+2KMnO4+3H2SO4=K2SO4+2MnSO4+2CO2+4H2O,使其褪色,
故答案为:酸性KMnO4溶液褪色;
(5)可燃性的气体与空气混合,点燃易发生爆炸,所以需在点燃前验纯,
故答案为:验纯.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与高锰酸钾溶液反应的性质.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
19.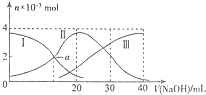 常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
 常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )| A. | H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O42- | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水小 | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O4-)+3c(H2C2O4)═c(C2O42-)+2c(OH-) | |
| D. | 已知H2C2O4的电离常数分别为K1、K2,则a点的c(H+)=K2 |
20.关于实验室制取乙炔,下列描述合理的是( )
| A. | 乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂 | |
| B. | 为了加快此反应的反应速率,通常往水中加入少许盐酸 | |
| C. | 将生成的气体直接通往溴水中,溴水褪色则证明产生了乙炔 | |
| D. | 通常采取向上排空气法收集乙炔 |
17.在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是5.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3,测得10min内NH3的平均反应速率是0.2mol/(L•min),则10min后N2的浓度是( )
| A. | 6.8mol/L | B. | 1.8mol/L | C. | 2.4mol/L | D. | 4.8mol/L |
4.下列各组气体中,比乙烯含碳量高的是( )
| A. | 甲烷和乙烯 | B. | 乙烷和丁烯 | C. | 乙炔和丙烯 | D. | 乙烯和丁烯 |
14.已知:
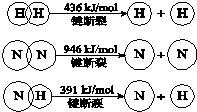
该合成氨反应的反应热为( )

该合成氨反应的反应热为( )
| A. | +92 kJ/mol | B. | -92 kJ/mol | C. | -92 kJ | D. | +1081 kJ/mol |
1.课本实验中出现的“草酸溶液与酸性高锰酸钾溶液反应,其反应速率逐渐加快”.经分析某粒子具有催化作用,该粒子是( )
| A. | H+ | B. | SO42- | C. | MnO4- | D. | Mn2+ |
18.下列关于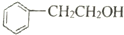 和
和 的说法不正确的是( )
的说法不正确的是( )
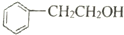 和
和 的说法不正确的是( )
的说法不正确的是( )| A. | 均属于醇 | B. | 均能发生消去反应 | ||
| C. | 均能发生催化氧化反应生成酫 | D. | 与氢卤酸反应时均断裂C-O |