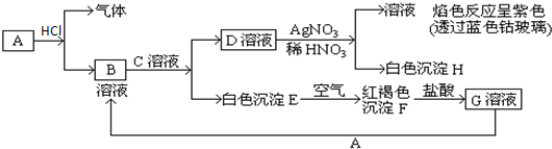
题目内容
10.金属钠切开后,光亮的金属断面变暗,说明常温下钠能够跟氧气反应,生成氧化钠;钠投入水中,钠浮水面上,并四处游动,发出响声,这说明钠比水轻,反应生成气体,熔成一个闪亮的小球,说明反应放热,钠的熔点低,最后向烧杯中滴加酚酞,溶液变红色,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑.分析 钠是很活泼的金属,在无条件下就能与氧气反应,所以在自然界中只能以 化合态存在;观察切开面,新切开的金属钠断面呈 银白色色,钠在无条件下就能与氧气反应生成氧化钠,所以在空气中很快变暗色,钠密度小于水,熔点低和水反应生成氢氧化钠溶液和氢气.
解答 解:金属钠切开后,光亮的金属断面很快变暗色,说明常温下钠和空气中的氧气反应生成白色固体氧化钠,钠投入水中浮水面乱游动,嘶嘶响说明钠密度小于水,反应过程中生成气体,钠熔点低,反应放热熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液变红色,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:变暗;氧气;氧化钠;浮;钠比水轻,反应生成气体;反应放热,钠的熔点低;红色;2Na+2H2O=2NaOH+H2↑.
点评 本题考查的是钠的物理性质、化学性质,通过阅读教材即可得出答案,属基础题.碱金属是典型金属元素的代表,钠是碱金属元素的代表,在无机化学中有非常重要的地位,因而成为命题的重点物质,是物质推断、鉴别、及有关实验、计算的常见物质.

练习册系列答案
相关题目
20.关于实验室制取乙炔,下列描述合理的是( )
| A. | 乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂 | |
| B. | 为了加快此反应的反应速率,通常往水中加入少许盐酸 | |
| C. | 将生成的气体直接通往溴水中,溴水褪色则证明产生了乙炔 | |
| D. | 通常采取向上排空气法收集乙炔 |
1.课本实验中出现的“草酸溶液与酸性高锰酸钾溶液反应,其反应速率逐渐加快”.经分析某粒子具有催化作用,该粒子是( )
| A. | H+ | B. | SO42- | C. | MnO4- | D. | Mn2+ |
18.下列关于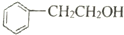 和
和 的说法不正确的是( )
的说法不正确的是( )
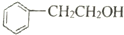 和
和 的说法不正确的是( )
的说法不正确的是( )| A. | 均属于醇 | B. | 均能发生消去反应 | ||
| C. | 均能发生催化氧化反应生成酫 | D. | 与氢卤酸反应时均断裂C-O |
15.把下列四种X的溶液,分别加入盛有10mL 2mol•L-1盐酸的烧杯中,并均加水稀释到50mL,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
| A. | 30mL 2mol•L-1 | B. | 10mL 5mol•L-1 | C. | 40mL 1mol•L-1 | D. | 10mL 3mol•L-1 |
2.下列叙述中正确的是( )
| A. | 1 mol任何气体的体积都约为22.4L | |
| B. | 在标准状况下某气体的体积约为22.4L,则该气体约含有6.02×1023个分子 | |
| C. | 16.0gCuSO4•5H2O溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 标准状况下,22.4LHCl气体溶于1L水中,所得溶液浓度为1mol/L |
20.把9mL NO气体装入试管,倒立于水槽中,逐渐通入O2,当试管中剩余气体为3mL时,通入O2的体积可能是( )
| A. | 9 mL | B. | 6.75 mL | C. | 4.5 mL | D. | 3 mL |