题目内容
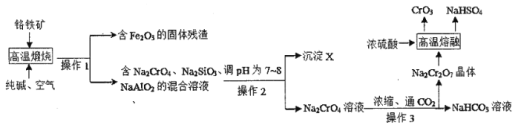
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为___。
(2)沉淀C的成分是___,溶液D中存在较多的阴离子是___。
(3)步骤③所加入的试剂是___,生成沉淀F的离子方程式是___。
【答案】![]()
![]() 、
、![]()
![]() 、
、![]() 和
和![]()
![]()
![]()
【解析】
首先加入过量盐酸,几种物质里只有![]() 不溶于盐酸,即沉淀B,其它元素全部进入溶液A,再加入过量烧碱,
不溶于盐酸,即沉淀B,其它元素全部进入溶液A,再加入过量烧碱,![]() 和
和![]() 转化为氢氧化物,即沉淀C,而所有铝转变为
转化为氢氧化物,即沉淀C,而所有铝转变为![]() 进入溶液D,接下来要进行一下逆推,工业上铝是电解氧化铝得到的,因此物质M是氧化铝,氧化铝又是从不溶于水的F转化来的,因此F是
进入溶液D,接下来要进行一下逆推,工业上铝是电解氧化铝得到的,因此物质M是氧化铝,氧化铝又是从不溶于水的F转化来的,因此F是![]() ,反应③其实是向
,反应③其实是向![]() 溶液中通入二氧化碳气体,故溶液E为碳酸氢钠(此步骤二氧化碳一般都是过量的),据此来分析本题即可。
溶液中通入二氧化碳气体,故溶液E为碳酸氢钠(此步骤二氧化碳一般都是过量的),据此来分析本题即可。
(1)蚀刻玻璃是用氢氟酸来溶解玻璃中的![]() ,其反应方程式为
,其反应方程式为![]() ;
;
(2)沉淀C的成分为![]() 和
和![]() ,而溶液D中存在较多的阴离子是
,而溶液D中存在较多的阴离子是![]() 、
、![]() 和
和![]() ;
;
(3)步骤③所加入的试剂是二氧化碳,生成沉淀F的离子方程式为![]() 。
。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3+ + 3HCO3-= Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
A. A B. B C. C D. D
【题目】研究铜和铁与浓硫酸的反应,实验如下:
① | ② |
| |
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
下列说法正确的是
A. 常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B. ②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C. 依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D. ①②中现象的差异仅是由于温度改变了化学反应速率