题目内容
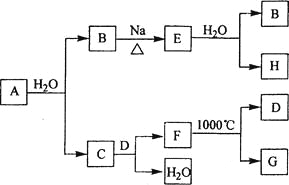
【题目】有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题:
(1)A在元素周期表中的位置 。
B的最高价氧化物化学式为 。
写出C元素气态氢化物的电子式 。
(2)D的单质与水反应的化学方程式为_ 。
(3)五种元素中原子半径最小的是______(填元素符号),这些元素的最高价氧化物的对应水化物中________酸性最强。
(4)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏(请写出计算过程)。
【答案】(1)第二周期第ⅥA族 P2O5![]()
(2)Cl2 + H2O=HCl + HClO
(3)O HClO4
(4)172
【解析】试题分析:A、B、C、D、E五种短周期元素,根据元素在周期表中的位置知,A为第二周期元素,B、C、D为第三周期元素,设C的原子序数为x,则A的原子序数为x-8,B的原子序数为x-1,D的原子序数为x+1,相邻的A、B、C、D四种元素原子核外共有56个电子,则x-8+x-1+x+x+1=56,则x=16,所以C为S元素、A为O元素、B为P元素、D为Cl元素,E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同,则E为Al元素。
(1)A为O元素,在周期表中位置是第二周期第ⅥA族;B为P元素,最高价氧化物化学式为P2O5;C元素气态氢化物为H2S,电子式为![]() ;
;
(2)氯气与水反应方程式为Cl2 +H2O=HCl+HClO;
(3)同一周期随原子半径随着原子序数增大原子半径减小,一般原子电子层数越多原子半径越大,故原子半径从小到大的顺序为O<Cl<S<P<Al,这些元素的最高价氧化物的对应水化物中HClO4酸性最强;
(4)尾气中C的氧化物SO2的物质的量为![]() ×2%=1000mol,根据S元素守恒n(CaSO42H2O)=1000mol,故m(CaSO42H2O)=1000mol×172g/mol=172000g=172kg。
×2%=1000mol,根据S元素守恒n(CaSO42H2O)=1000mol,故m(CaSO42H2O)=1000mol×172g/mol=172000g=172kg。

【题目】

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响? (填“偏大”“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面: 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水: 。
(4)硅单质是一种重要的非金属单质,其用途是 (举一例)
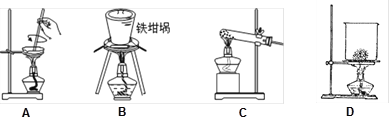
(5)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(6)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。