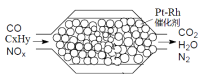
题目内容
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下填空

(1)锌为:________极(填“正”或“负”)电极反应式为:_______________,
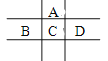
(2)反应过程中电流的方向为:____________
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了____________mol电子发生转移,铜片上产生气体的体积(标况下)为:________________L
【答案】(1)负极,电极反应式为:Zn – 2e- = Zn2+;(2)A ;(3)0.02mol,0.224 L。
【解析】
试题分析:(1)根据原电池构成条件,活泼金属作负极,根据金属活动顺序表,锌比铜活泼,因此锌作负极,其电极反应式为Zn-2e-=Zn2+;(2)根据原电池的工作原理,电子从负极经外电路流向正极,而电流是正电荷定向移动,从正极流向负极,故选项A正确;(3)根据电极反应式,转移电子的物质的量为0.65×2/65mol=0.02mol,正极反应式2H++2e-=H2↑,产生V(H2)=0.02×22.4/2L=0.224L。

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。